検出された遺伝子異常が生殖細胞系列変異かどうか問題

がん遺伝子パネル検査で発見される遺伝子異常が二次的所見であるかどうかはいつもエキスパートパネルのメンバーを悩ませる問題の1つです。それらが体細胞由来なのか生殖細胞由来なのかを判断することは容易ではありません。
がん遺伝子パネル検査の運用が始まった頃は、変異アレル頻度が50%に近いかどうか、家族歴がマッチするかどうかということをもとに推定を行っていました。しかし実際には変異アレル頻度が低くても、あるいは家族歴がなくても生殖細胞系列の異常であることが少なくないことがわかってきました。
ESMO Precision Medicine Working Group (PMWG)の研究結果から、T-only panel(腫瘍の細胞のみを用いたがん遺伝子パネル検査)での解析でどのように考えるべきかヒントになるような文献が出ていましたので読んでみたいと思います。

まず考えておくべき前提知識
T-only panelで検出されたがん感受性遺伝子(CSG:cancer susceptibility genes)の遺伝子異常は生殖細胞系列にある遺伝子上であるかどうかを判断する前に知っておくべき前提知識がありますのでこれについて言及しておきます。
「On腫瘍」と「Off腫瘍」
その患者ががんの種類はその遺伝子上に関連するかどうかを考えます。例えば乳癌組織で検出されたBRCA1異常は、BRCA1異常が乳癌リスクを高めることからOn腫瘍と考えられます。一方で、同じBRCA1異常を有していてもそれが乳癌組織ではなく精巣腫瘍組織であった場合には、BRCA1異常と関連があった可能性はやや低くなるためOff腫瘍と考えられます。Off腫瘍の場合は生殖細胞系列変異の可能性を考える可能性が強まりそうだと言及されています(個人的には、必ずしもそうとも言えないケースも少なく無い気はしますが)。
なおOn腫瘍な遺伝子異常で体細胞変異のみの確率が特に高いものとして、大腸癌のAPC(APC遺伝子異常があっても家族性大腸腺腫症ではない散発性大腸癌が多い)と腎癌のVHL(腎癌でもVHLの体細胞変異が多い)などが挙げられます。上記のESMOの報告によるとVHL異常を有する腎癌の82例中79例は体細胞変異であり、大腸癌のAPCにいたっては体細胞変異であった割合は0.3%に過ぎなかったとされています。このように、VHLやAPCなど一部の遺伝子はそれがどの臓器から検出されたのか(On腫瘍なのかどうか)が重要なのです。
臨床的にactionableかどうか
もしCSG異常が生殖細胞系列にあるものであったと言うことがわかったとして、それが今後の(本人のみならず血縁者も含めて)治療や予防に有益な情報であればそれはactionableな変異であるといえます。ちなみに、actionableであるかどうかという遺伝子はACMGのものを含めてリストが公開されており、大変参考になります。
遺伝性腫瘍の浸透率
生殖細胞系列のCSGに遺伝子異常があったとしても必ず発癌するわけではないことが知られています。がん遺伝子パネル検査の普及によって、これまで推定されていたよりもずっと高い頻度でCSGに異常があることがわかってきました。裏を返せば遺伝性腫瘍とされていた疾患群の浸透率(CSG異常を有する人が実際に発がんする確率)はこれまで考えられていたよりもずっと低い可能性があります。
変異アレル頻度に影響する因子
変異アレル頻度(VAF:variant allele fractionまたはvariant allele frequency)は、シーケンサーのその遺伝子の検出回数に対して変異が陽性であった回数の割合を示す値です。たとえば10,000個の細胞のTP53遺伝子をシークエンスしたときにそのうち3,000個の細胞が片方(父由来か母由来のいずれか)のアレルにTP53遺伝子変異を持っていれば、VAFは分子が3,000で分母は10,000×2ですから、VAFは15%になります。
もし純粋に生殖細胞系列の遺伝子異常であるならば理論上は変異アレル頻度(VAF)はちょうど50%になるはずで、50%より大幅に低いVAFであればその遺伝子上は体細胞変異であることが推測されます。しかし実際にはこの通りにはなりません。VAFに影響する因子が多々あるからです。
ヘテロ接合性の喪失
父母から50%ずつのDNAを受け継いだ後、どちらか片方だけの対立遺伝子に欠失などが起こることがあります。片方の遺伝子が失われるために父または母のどちらかから受け継いだほうだけが残り、これはヘテロ接合性の喪失(LOH:loss of heterozygousity)と言われることがあります。単純に片方の遺伝子が欠失したことで遺伝子が1つしか残らないというケースもありますが、細胞分裂が起こるタイミングで有糸分裂組換えが起こって娘細胞には父由来または母由来のどちらか片方だけの遺伝子が2対受け継がれるというケースもあります。
ヘテロ接合性の喪失は、(正常な細胞分裂を繰り返している非腫瘍細胞でもおこることはあるものの稀ですが)腫瘍細胞は異常な細胞分裂を繰り返した結果としてしばしば見られます。またがん抑制遺伝子のヘテロ接合性の喪失そのものが発癌の発端であることもあります。
多くのがん抑制遺伝子では1本に異常があるだけでは発癌しないが、細胞内有糸分裂組換えなどが加わると2本とも変異を持つ細胞が生じる。この図では右から2本目の細胞ががん化する。右下4つのVAFはそれぞれ50% 50% 100% 0%となる。 pic.twitter.com/0vWJqB2CLE
— レ点.bot💉💊🧬 (@m0370) April 15, 2020
増幅や欠失などの染色体異常の影響
腫瘍細胞では頻繁に染色体異常が生じ、変異や欠失のほかに増幅などもあるので染色体数が2とは限りません。遺伝子コピー数が数十に及ぶこともあるので、1hitの変異でVAFが50%とは限りません。当然、変異がある側の対立遺伝子に増幅が起こればVAFは50%を大きく上回りますし、逆であれば50%を大きく下回ります。
ちなみに、遺伝子単位でのLossやエクソン単位のLossなど大きな範囲で遺伝子配列が抜け落ちている場合は二次的所見である可能性は低いと考えるのが一般的のようです(欠失範囲が広ければ広いほど遺伝的には受け継がれにくいと考える)。このため開示対象に挙げる必要性はあまり高くありません。また、T-only panelでエクソン単位のような欠失などを認めた場合には確定診断的検査も実施できないことが多いのが実情です。
正常細胞混入の影響
腫瘍組織でも腫瘍細胞のみで形成されているわけではありません。血管が走行していたり間質細胞があるなどして腫瘍細胞含有率は下がります。膵癌のように脂肪組織内にまばらに腫瘍細胞が散在するような組織では腫瘍細胞含有率はさらに下がります。このためシークエンスする検体の腫瘍細胞含有率を事前にプレパラート上で検討し、FoundationOne CDxの場合は30%以上保たれている検体を提出することが求められています。
次世代シークエンサーはサンプルとして投入されたDNAが腫瘍細胞由来か正常細胞由来かを区別してシークエンスしているわけではないので、腫瘍細胞含有率が低い検体では「腫瘍DNAを正常細胞DNAで希釈した検体」を読んでいることになり、見かけ上のVAFは低く算出されます。
ただし、もし生殖細胞系列由来の遺伝子変異であれば正常細胞DNAにもその変異があることになりますので、腫瘍細胞含有率が低ければ低いほど「腫瘍DNAを正常細胞DNAで希釈した検体」ではVAFは50%に近づくことになります。
シークエンスの機械精度的な問題
ほかにシークエンス上のエラーや誤差という検査精度上の問題も考えると、VAFに影響する要因は非常に幅広い範囲に見られると言えるでしょう。
特にNGSにはハイブリッドキャプチャーベースのものとPCRアンプリコンベースのものがありますが、PCRアンプリコンベースのNGSは遺伝子のライブラリ調整までの過程が安定しにくいためVAFの値がぶれやすい傾向にあります。また固定条件や保存状態に問題があるFFPE(過固定や古い検体など)でもDNAが短く断片化されてPCR増幅効率が落ちるためVAFの誤差が大きくなり得ます。さらには、未知の融合遺伝子(パネル設計が想定していない融合DNA配列)が存在する場合にはPCRアンプリコン法はその異常を検出できません。PCRアンプリコンベースのNGSは検体量が少なくてもシークエンスができる上に低コストで結果が得られるのも早いというメリットがありますが、ハイブリッドキャプチャーベースにも強みがあるのです。
ちなみに本邦で現在使われているがん遺伝子パネル検査では、NCCオンコパネルとFoundationOne CDxの2種類はいずれもハイブリッドキャプチャー法、一方で肺癌領域でコンパニオン診断などのために使われているオンコマインTarget Testはアンプリコン法を用いています。
シークエンスの機械精度的な問題(特にindelについて)
indelとはinsertion/deletion、つまり挿入変異・欠失変異のことを指した「俗語」です。コドンは3つの塩基ごとに1つのアミノ酸をコードした読み枠に従っていますが、これが1塩基分ずれるとそれ以降の全てのアミノ酸のコーディングがめちゃくちゃになってしまい、遺伝子の機能が破綻します。たとえばBRCA1 c.143delTはphatogenic変異の1つですが、143番目のTが欠落(deletion)したことによって48番目のコドンのメチオニン以降の全てのコドンの読み枠がズレてしまうためBRCA1の機能が失われてしまいます。
indelに対するSNVは単塩基変異です。BRCA1 V1736Aは5270T>C、つまりDNA上の5270番目の塩基のTがCに置き換わったことによって1736番目のコドンがVからA(バリンからアラニン)に変化したことによって起こる変異です。このような単塩基が別の塩基に置き換わることによって生じるSNVは多くのシークエンサーが比較的高精度に読み取ることができます。
indelは状況によってシークエンサーのエラーが起こりやすいと言われています。特に同一塩基がAAAやTTTのように連なる場面に起こるindelはエラー率が高くなります。なお、FoundationOne CDxやNCCオンコパネルが使っているイルミナのNGS(蛍光でシークエンスするタイプ)に比べて、イオンプロトンなどのNGS(電位でシークエンスするタイプ)はindelのエラー率が高いという弱点が登場当初は言われていました(最近はかなり是正されてきているようです)。
したがってindelのVAFはSNVのVAFに比べてデータの信頼度が若干低い可能性があります。
リキッドバイオプシーでは
Guardant360の場合は末梢血中に混じるごく微量のctDNAを検出するという検査の特性上、拾い上げられるほとんどのDNAはその人の白血球や血管内皮細胞などの生殖細胞系列に由来するDNAということになります。その原理を考えるとの体細胞変異(somatic変異)のVAFがGuardant360では0.3〜3.0%程度と極めて低くなるのに対して生殖細胞系列変異があれば40%を越えるはずで、40%を下回るVAFであれば生殖細胞系列変異である可能性はほぼ除外できそうです。なお、今後普及するであろう造血器腫瘍に対するリキッドバイオプシーの場合は別途考える必要があることに注意が必要です。
カットオフ値の設定方法による問題
明らかに遺伝性腫瘍につながることがわかっている遺伝子であっても、そのカットオフ値をどのように設定するかはまた関係者を悩ませる問題です。これについては明確な基準はありませんが、英国ではBRCA1については10%というような基準値が定められているようです*1。
本邦では暫定的に小杉班提言などをもとに、SNV(点突然変異)はVAF 30%を、indel(挿入変異・欠失変異)はVAF 20%を使うことが多いようですが、今後データが積み重ねられて新たなエビデンスが作られれば変更されてゆく可能性はあります。
そもそも未知のことがらが多い(科学的な限界)
がん遺伝子に関する研究はどちらかというと生殖細胞系列変異よりは体細胞変異を主たるターゲットとして研究開発されてきました。腫瘍の病態と生殖細胞系列の遺伝子異常についてはまだわかっていないことが多すぎます。臨床的意義不明の変異(VUS:variant of unknown significance)という言葉が指し示す通り、現時点の医学では判断できないケースも多々あるという科学的限界を認識しておかなければならないでしょう。
さて、以下は実際にESMOのグループが検討した結果を見てみたいと思います。この研究は17,152例もの腫瘍と生殖細胞系列の遺伝子異常を比較検討した壮大な研究で、現時点で入手できるデータセットとしては最も大きなものではないかと思われます。

注意を要する点
本研究では17,152例のうち、あらかじめフィルターによって一定の遺伝子異常を除外していることに注意が必要です。検出された遺伝子異常の分母が実臨床の母数よりも狭くなっている可能性があることについて気をつけて解釈する必要があります。
とくにはじめに830例のhypermutation症例が除外されていますので、ミスマッチ修復遺伝子異常などについては正しく評価できない可能性があります。また、一般人口の1%以上の人がもっている遺伝子多型(SNPなど)が除外されていますが、西洋人とアジア人ではこれの影響が違うことも考えられます。さらには、Clinvarでpathogenicまたはlikely pathogenicと判定されたものについて解析していること、およびVAF 30%未満のSNVとVAF 20%未満のindelを除外していることにも気をつけてください。先ほど述べたBRCA1のカットオフ値がVAF 10%とされていましたから、それよりは大幅に「選び抜かれた遺伝子変異群」です。言い換えれば、「やや濃縮された母集団」を対象とした研究です。
ところで、SNVでVAF 13%でもgermiline変異だったという報告がどこかにあったような(ソースは捜索中)ので、このSNVはVAF 30%でindelはVAF 20%というカットオフ値の決め方は若干乱暴さを感じるような気がしなくもありませんが。。。
個別の検討事項について
TP53
TP53はもっとも高頻度に異常が見つかった遺伝子で2,930例に変異が指摘されています。しかし皆さんがご存じのようにTP53でVAFが高い変異が見つかってもリ・フラウメニ症候群が実際に存在することは極めてまれです。本研究においてもVAF 30%以上のSNVなどの絞り込みをしても、2,930例中のわずか30例(1.0%)しか生殖細胞系列にTP53変異が無かったとされています。ちなみに、リ・フラウメニ症候群に関連する腫瘍と比べてOff腫瘍である場合は2,144例中わずか14例(0.6%)しか生殖細胞系列変異を認めませんでした(逆に言うとOn腫瘍*2は16/786例で2.0%)。
さて少数しか見つからなかったとはいえ、この少数例は実際にリ・フラウメニ症候群を持っていたわけです。ではTP53でVAFが比較的高い異常を認めたときに生殖細胞系列変異を疑うべきなのはどういうポイントなのでしょうか。それもこの研究で言及されています。
全体ではTP53変異を認めたのは2,930例でしたが、30歳未満の1,273例で再検討するとTP53に体細胞系列+生殖細胞系列のいずれかに病的変異を有するのは174例で、うち生殖細胞系列にTP53病的異常があったのは11/174例(6.8%、脳腫瘍を除外すれば11.7%)でした。30歳未満に限定するとTP53異常が生殖細胞系列に由来する可能性が大幅に高まることがわかります。臓器別で見ると体細胞変異にTP53変異があるのはgliomaが最多ですが、gliomaのTP53はほとんどが体細胞変異(57例中56例)です。
gliomaについてTP53変異が多いのは乳癌・軟部腫瘍・大腸癌・骨腫瘍・非小細胞肺癌と続きますが、この5つはいずれもTP53変異が見られたうちの10〜20%は生殖細胞系列にも異常が見られた、つまりリ・フラウメニ症候群に由来する発癌であったと言えますので、TP53変異を認めた場合には年齢が若年かどうか、また原発臓器が乳癌・軟部腫瘍・大腸癌・骨腫瘍・非小細胞肺癌などであるかどうかを考えることで絞り込みを行うことができそうです。具体的には、30歳未満で脳腫瘍以外なら考える、乳癌・軟部腫瘍・大腸癌・骨腫瘍・肺癌ならさらに強く疑うということですね。なお、リ・フラウメニ症候群では白血病が起こる頻度も高いのですが本研究では白血病の症例は含まれていないのでこのあたりは不明です。
VHL
前述のとおり、VHL異常を有する腎癌の82例中79例は体細胞変異であったと報告されています。したがって腎癌の場合は生殖細胞系列変異である可能性はあまり考える必要がありません。
APC
大腸癌では多段階発癌のadenoma-carcinoma sequenceの過程でβカテニン経路の異常に関わるAPC変異を獲得するステップがあります。このため、大腸癌に見られるAPC遺伝子異常の大部分は家族性大腸腺腫症とは関係ないもので、実際に本研究では家族性大腸腺腫症を有したのはAPC異常を有する大腸癌のうち0.3%に過ぎないと報告されています。したがって大腸癌の場合は生殖細胞系列変異である可能性はあまり考える必要はありません(おそらく小腸癌と胃癌も同様の議論が成り立つはずですが、そもそも小腸癌は希少がんであるため別の意味で遺伝性腫瘍である可能性を考える必要があります)。
MUTYH
常染色体劣性遺伝という遺伝形態をとる関係上、ヘテロ変異ではなくホモ変異の場合のみ考慮すべきとされています。今のところ遺伝性腫瘍・二次的所見に注意が必要で劣勢遺伝の形態をとるのはMUTYHだけです。
若年例
30歳未満で生じた遺伝子異常では検出された遺伝子異常が生殖細胞系列に由来する可能性が10%以上まで高まります。これらの若年がん患者ではRB1、APC、NF1などがよく見られる遺伝子異常でした。
hypermutatedのケース
別途、hypermutatedの例についても解析が行われています。これによると、上位5%に入るhypermutatedな腫瘍の10%はMLH1, MSH2, MSH6, PMS2にミスマッチ修復遺伝子異常を有したようです。一方で別のhypermutatedに関与するPOLEについては、組織DNAにPOLE病的変異を持っていた14例のうち1例だけが生殖細胞系列にも異常を持っていたようです。
ちなみに日本では
ちなみに日本では、AMED小杉班からゲノム医療に関する様々な提言がなされています。その中で「二次的所見の生殖細胞系列確認検査運用指針例*3」に関するフローチャートが掲載されています。
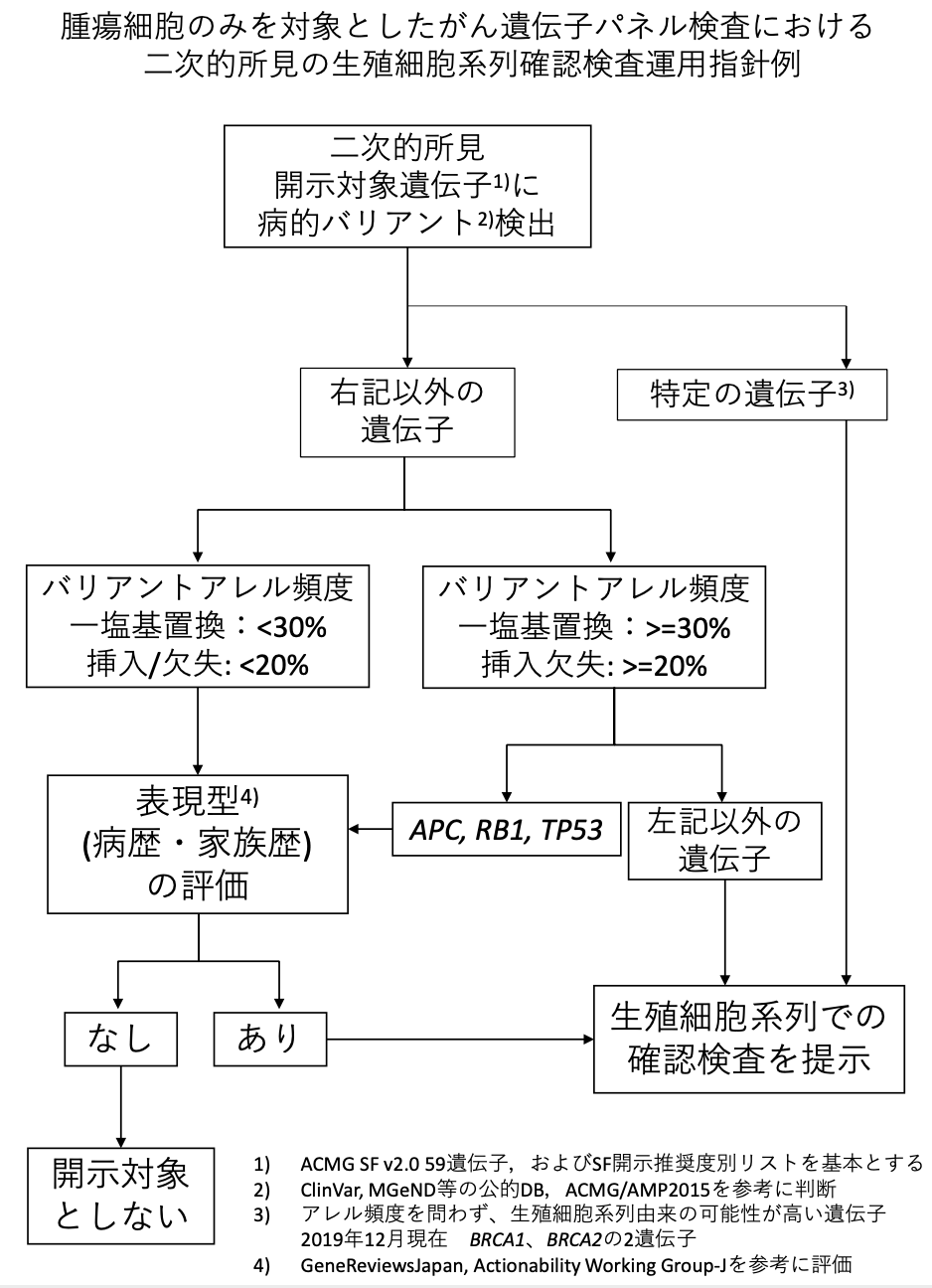
これを見てみますと、上記のESMOの文書とは異なる点がいくつかあります。
まずBRCA1とBRCA2はバリアントが見つかった時点でVAFによらず生殖細胞系列変異の確認を提示することとされています。2019年12月時点ではこの2つの遺伝子、と記載されているので今後はATMなどその他のHRD関連遺伝子が追加される可能性もあります。
また、SNV(単塩基変異、たとえばmissenseやnonsense変異など)は30%、indel(挿入変異・欠失変異、たとえばframeshiftなど)は20%をカットオフ値とするところはESMOと同じなのですが、ESMOでは別枠扱いとしていた遺伝子がTP53・VHL・APC・MUTYHであったのに対して、このAMED小杉班のフローチャートではTP53・APC・RB1が別枠とされています。確かにRB1は病歴から効率に生殖細胞系列の異常かどうかが推定できるので別枠とするのは一定の合理性があるように思われます。
まとめ
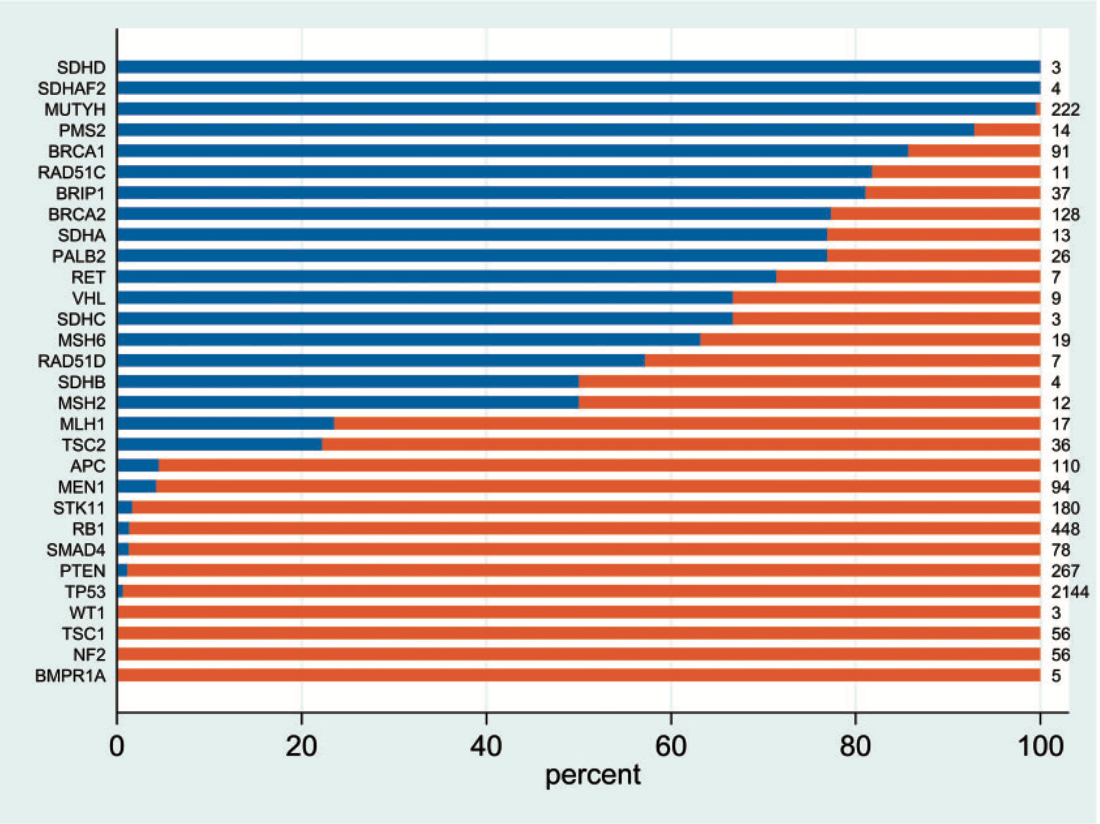
検出された遺伝子異常のうち生殖細胞系列であった割合は遺伝子ごとにかなり変わることがわかりますが、先にも述べたとおり、もともとこの研究はVAFが一定値以下のSNVやindelをフィルタリングしていますので普段のがん遺伝子パネル検査で検出された遺伝子異常について考える場合はこの数値をそのまま当てはめることはできません。

結局ESMOのこのグループでは上記の27遺伝子を注意すべき遺伝子異常としてあげています。絞り込んだ根拠はdiscussionのパートに書かれているとおり、これに含まれていないものは組織DNAで検出されても生殖細胞系列変異である可能性が高くないためとされています。ACMGの遺伝子リストに掲載されているのが59遺伝子ですから、それよりも大幅に絞り込まれていると言えますね。
ちなみにRB1、APC、TP53、NF1は30歳以下のみで考慮することになっており(ただしTP53は脳腫瘍については年齢制限なし)、極めて検出される頻度の高いTP53が年齢制限が付いているのはエキスパートパネルの議論が進みそうです。
そして、ここまでの議論を経て下記のような推奨を出すに至っているというわけです。

これらのうち、私たちが気をつけておくべき点を抜粋すると以下のようになるでしょうか。
- 検出された遺伝子変異がタンパク質にどの程度影響するのかという機能性の変化をClinvarなどのデータベースで確認すること(これはすでに普段からやっていますね!)
- VAFはSNVなら30%でindelなら20%をおおまかなカットオフ値と考えること(これについてはそのまま鵜呑みせず、要検証と考えています)
- PCRアンプリコン法のNGSの場合はVAFの解釈に注意(これはFoundationOne CDxやNCCオンコパネルなら大丈夫です)
- 生殖細胞系列の遺伝子異常の検討は治療などにつながるactinoableな遺伝子を重点的に行うこと(ACMG59や小杉班のリスト、そしてこのESMOの推奨を利用しましょう)。off腫瘍な範囲は特にactionableかどうかに気をつける。
- MUTYHは2アレルに異常がなければ表現型に繋がらないという他の常染色体優生遺伝とは異なる考え方が必要ということを知っておく!
- ある程度の浸透率がある遺伝性腫瘍を特に注意してフォローする
- 年齢が30歳未満かどうかで絞り込み(完璧なカットオフ値ではない)
- 何より、経験豊富な専門家のコンサルテーションのもとで判断を行うことが重要
この文章を元に思ったことは、当初はESMOの提言っていうものだから何かすごいことが書いてあるのかと思っていたのですが、特にVAFのカットオフ値などは意外にテキトーに決められているんだなということです。結局はまだわかっていないことが多いので、あまり細かいところまで踏み込んだ提言をするのは難しいということでしょう。ICIの有効性予測するTMBのカットオフ値やMSI-HとMSI-Lの閾値などもそうですが、何か科学的な裏付けによって決まっているというよりは、とりあえずみんなのコンセンサスが得られそうなところでズバッと切っておいて、細かいところはあとで考えようということなのかもしれません。。。
この記事に対するコメント
このページには、まだコメントはありません。
*1 Familial breast cancer: classification, care and managing breast cancer and related risks in people with a family history of breast cancer, National Institute for Health and Care Excellence, 2013.
*2 Supplemental Figure 3Aを見るとTP53のOn-tumourは乳癌、乳房肉腫、軟部肉腫、子宮肉腫、副腎皮質癌、骨悪性腫瘍、Gliomaおよびその他の中枢神経悪性腫瘍が挙げられています。
*3 https://www.amed.go.jp/content/000056785.pdf
更新日:2020-10-05 閲覧数:5581 views.