遺伝子別

FoundationOne CDxなどのがん遺伝子パネル検査で検出される遺伝子異常と悪性腫瘍の関連に関する、個人的なメモです。量が多いので一部カバーしきれていませんが、本ページの記事は随時追記しています。正確な内容になるよう注意はしていますが誤っている可能性や古い情報であることもあるので、常にご自身で正確かつ最新の情報で検証するようにしてください
- 2020.5.25に初版を作成し、以後も月1〜2回のペースで追記を継続していますが、最新の情報でない可能性があります。
- 多くのブラウザでは、ページ内で目的のキーワードが見つけられない場合はctrl+F(Macではcommand(⌘)+F)を押すことでページ内検索ができます。

目次

重要な参考資料
がん遺伝子パネル検査で検出された遺伝子異常の病原性などを調べるためのデータベースなどのリスト。
Clinvar
がんゲノム異常に関して最も重視されているデータベース。C-CAT調査結果報告書でもClinvarの掲載があるかどうかをレポートに含めて報告される。がん遺伝子パネル検査で遺伝子変異が検出された場合はまずここで病原性を調べることが重要。

VarSome
Clinvarで変異を検索しても登録されていない場合にVarSomeでは登録があることがある。また同一塩基変異の「別名」がVarSomeで表示されることがあるので、この別名をClinvarで再度検索すると登録があることがある。なお、VarSomeのフル機能を使うのは有償となる。

COSMIC
Clinvarに次いで重視されるデータベース。がん遺伝子変異に関するデータ量は遺伝子の種類によってはClinvarより多い。COSMICは文献で報告された遺伝子変異を遺伝性と関係なく収載しているので収載されているのはsomatic変異が大部分を占めると考えられる(したがって二次的所見の病原性判断するにはCOSMICよりClinvarを優先する)

日本版がんゲノムアトラス(JCGA)
もともとTCGAという大規模ながんゲノムアトラス計画があり、2011年ごろから盛んに様々な臓器の悪性腫瘍の遺伝子変異網羅解析の結果がトップジャーナルに掲載されました。その結果が今のCOSMICなどを作っているわけですが、JCGAはその日本人データ版です。ToMMoは日本人のSNP(生殖細胞系列多型)を収載しているのに対し、JCGAは日本人の悪性腫瘍に見られる(主に)somaticな遺伝子異常を載せているという違いがあります。
OncoKB

遺伝子別データベースとして重要なものとしてOncoKB(Precision Oncology Knowledge Base)が最近急速に知られるようになってきた。

PolyPhen-2
蛋白質の機能異常をin silico(コンピューター上のシミュレーションなどによる評価法で)で評価したもので、その遺伝子変異が蛋白質の立体構造や機能などにどの程度影響するのか推測をすることができる。あくまで遺伝子変異が蛋白質の機能にどの程度影響するかという観点からの評価なので、臨床的に影響までを判断できるとは言えないことに注意。
二次的所見関係
小杉班リスト
がんゲノム医療を進めるにあたって、クリニカルシークエンスが拾い上げる二次的所見への対応の必要性が高まっています。これに関して日本医療研究開発機構(AMED)のゲノム創薬基盤推進研究事業が実施され、様々な提言がなされています。とくに実臨床において重要な資料として二次的所見を患者にどう開示すべきかに関する推奨度のリストがあり、これはがん遺伝子パネル検査の実務に関わる医療者は頻繁に参照し、その内容を把握しておく必要があります。
がん遺伝子パネル検査二次的所見患者開示 推奨度別リスト(改訂第4.2版)(2023年10月)

ACMG59リスト
ACMGが提示する二次的所見に関するデータも重要な参考資料になる。
https://www.ncbi.nlm.nih.gov/clinvar/docs/acmg/
https://www.ncbi.nlm.nih.gov/pubmed/27854360
AKT1
第3相CAPItello-291試験の結果から、PIK3CA変異陽性乳癌に対してAKT阻害剤カピバセルチブがフルベストラントとの併用で2023年11月にFDA承認された*1。この試験ではSERD・mTOR阻害薬・PI3K阻害薬・AKT阻害薬の投与歴があると除外されていることに注意する。本邦ではカピバセルチブは未承認である。なお、米国ではコンパニオン検査としてはFoundationOne CDxが指定されている。2023/11
トリプルネガティブ乳癌に対して中外製薬からイパタセルチブの第3相試験が進行中。
乳癌
イパタセルチブはPIK3CA/AKT1/PTEN変異を有する進行乳癌などに対して2020年に保険承認の可能性あり。TNBCに対してはイタパセルチブ+アテゾリズマブ+細胞障害薬の試験も進行中(IPATunity170試験)。
カピバセルチブは、TNBCの一次治療でPAKT試験(第2相)においてパクリタキセルとの併用でPFSが3.7→9.3ヶ月まで延長あり*2。
ER陽性乳癌の一次治療ではBEECH試験(第2相)においてパクリタキセルとの併用でPFSの延長が認められず(PFS 8.4→10.9ヶ月)、PIK3CA変異陽性の患者群に絞ってもその差は見られなかった(PFS 10.9→10.8ヶ月)*3。
ER陽性乳癌の二次治療ではFAKTION試験(第2相)においてフルベストラントとの併用でPFSが延長された(PFS 4.8→10.3ヶ月)。*4
乳癌以外
第2相試験では胃癌でFOLFOXにイパタセルチブを併用してもPFSの延長は見られなかった(PFS 7.7→6.5ヶ月)*5。
PTEN欠損去勢抵抗性前立腺癌ではイパタセルチブの開発が進行している。PTENの欄を参照。
ALK
ALK融合遺伝子
ALK fusionに対しては非小細胞肺癌ではアレクチニブなどを含むALK阻害剤が標準治療である。ALK阻害剤の中ではfusionの結合部位によってはクリゾチニブやセリチニブなどは効果が乏しいことがある。
非小細胞肺癌以外でもALK融合遺伝子陽性の脳腫瘍(Glioma)に対してロルラチニブが著効したとの報告がある*6。また急性骨髄性白血病(AML)でもALK融合遺伝子がしばしば報告されており、AMLに対する標準治療の有効が乏しい一方でALK阻害剤が有効であることがしばしばある。
逆にALK陽性肺癌に対して急性骨髄性白血病治療薬のギルテリチニブが有効*7であることもあり、ALKを介した非小細胞肺癌と急性骨髄性白血病の興味深い関係を示唆する。このギルテリチニブはロルラチニブなど従来のALK阻害剤が無効となったALK陽性肺癌に対しても有効性を示すことが知られている*8。
ALK 単塩基変異・挿入欠失
ALKのうち治療標的となるのは染色体の融合/再構成のみで、SNVやindelなどの変異やloss/gainが治療標的となることはほとんどない。しかし例外もあり、ALK F1174LやR1275Qは神経芽細胞腫においてALKの活性化変異として報告されている*9。なお、この場合も神経系細胞以外ではそもそもALK蛋白質自体が転写されていないことがあり、その場合は活性化変異があっても病的意義を持たないこともある。
ALK阻害剤治療中に出現するALK点突然変異はALK阻害剤の耐性を生むことがしばしばある(たとえばALK C1156Y、L1196M、G1269AなどはATP結合部位の立体構造を変化させてクリゾチニブがALK蛋白質に結合できなくするためクリゾチニブ耐性をもたらすALK変異として知られる)。
G1202RやI1171Nはアレクチニブ・クリゾチニブなどの耐性変異として知られているが、ロルラチニブはこれらの耐性を克服して有効であることが知られている*10。一方で、L1198Fはロルラチニブ耐性変異だが同時にクリゾチニブの感受性を回復させてクリゾチニブでの再治療が可能になるという報告もある*11。
ALK阻害剤の耐性変異についてはこちらのサイトが詳しい。

ALK増幅
クリゾチニブに耐性となる原因としてALK増幅が報告されている*12。ALK阻害剤の治療標的と言うよりはむしろALK阻害剤の有効性を否定する因子となる可能性がある。
APC
somaticには、adenoma-carcinoma pathway(つまり通常型散発性大腸癌)で高頻度に不活化変異が見られるなど消化管癌ではcommonな遺伝子異常。現時点でAPC異常に対する標的治療は無い。
二次的所見
APCに病的変異を認める場合は家族性大腸腺腫症(FAP)の可能性について考慮する必要がある。FAPの場合は成人後はポリポーシスがほぼ必発で、大腸ポリープが少ないattenuated typeでもポリープは10個以上存在するため、20〜30代以降で大腸ポリープが10個未満であればFAPの可能性は除外して問題ない(つまりポリポーシスがない場合は二次的所見の可能性は極めて低い)。
その特徴的な表現型と浸透率の高さなどを考慮して、小杉班の「がん遺伝子パネル検査 二次的所見 検討資料 Ver 1.0 20210816版」では、開示推奨度はAAAながら、T-only panelで生殖細胞系列バリアントの確認を推奨するのは30歳未満の症例と追記された。
遺伝性腫瘍(家族性大腸腺腫症)
家族性大腸腺腫症(FAP)の原因遺伝子。しかしFAPによる消化管腫瘍(大腸癌、胃癌、小腸癌)以外ではこれがドライバー変異であることはそれほど多くない。T-only panelでAPC異常を検出した場合は二次的所見の有無に注意を払う必要がある(小杉班リスト20191210では開示推奨度は最上級のAAAだがgermline test推奨度は△)。
先天的にAPC異常を有する家族性大腸腺腫症の場合は20〜50歳で極めて高頻度に大腸癌を発症するため予防的大腸全摘術が考慮されるが、近年は大腸全摘は行わずに内視鏡的大腸ポリープ切除術を繰り返す選択を取られることもある。
大腸以外には十二指腸(5-10%)・膵臓(2%)・甲状腺(2%)・髄芽腫(1%未満)・肝芽腫(小児で1%未満)を伴うことがある。下顎骨に腫瘍を伴うものはガードナー症候群と呼ばれ、歯科から紹介された場合は大腸内視鏡を考慮すべき。
大腸全摘後は定期的な上部内視鏡検査、年1回の甲状腺診察・甲状腺エコーなどが推奨されている*13。COX2阻害剤(セレコキシブ)が大腸全摘後も消化管癌を抑制する可能性が示唆されて*14、米国ではFAPに対するセレコキシブが承認されている*15。
AR
前立腺癌
去勢抵抗性前立腺癌でAR増幅が見られることがある(前立腺癌以外では稀)。内分泌療法の耐性変異の1つとされており前立腺癌では新規ホルモン剤が標準治療と考えられているが、前立腺癌以外についてはAR変異に対する標的治療は無し。またコピー数8以上の増幅でエンザルタミド・ビカルタミドの有効性も乏しくなるという報告もある。
唾液腺癌
唾液腺癌でもアンドロゲン受容体陽性唾液腺癌がしばしば報告される*16。DNAシークエンスによるmutationではなく、免疫染色でのAR陽性唾液腺癌に対してはNCCNガイドライン2023.2版〜でリュープロレリンやビカルタミドが推奨*17されている。本邦では厚労省通知*18により、2024年3月からAR陽性唾液腺癌に対してリュープロレリンまたはビカルタミドを使用した場合に当該使用事例を審査上認めることが明らかにされたため保険診療で使用可能となった。国内第2相試験*19によると、この2剤は併用療法として使用し、ORR 41.7%、OS 30.5ヶ月、PFS 8.8ヶ月であった。
日本で実施されたAR陽性唾液腺癌に対してアパルタミド(ARシグナル伝達阻害剤)とゴセレリン(LHRHアナログ)を投与する単群第2相YATAGARASU試験は、ORR 25%であった(主要評価項目はORR 24例中8例)*20*21。
ARAF
性染色体(X染色体)上にある遺伝子のため、特に男性の場合はVAFの解釈に注意を要する。
ARAFのホットスポットであるS214F活性化変異に対してソラフェニブで約5年にわたる長期SDが得られた肺腺癌の症例報告がある*22。この報告では、基礎的検討でもS214F変異はソラフェニブの高感受性変異である可能性が示唆されている。ただし古い報告が1報のみなので解釈には注意を要する。
ARID1A
ARID1A病的変異の進行癌に対して経口ATR阻害剤セララセルチブ(AZD6738)を単剤およびオラパリブと併用する第2相試験がESMO2021で発表された*23。なお、ARID1A病的変異により機能を欠失すると免疫染色でBAF250a蛋白質の発現が消失するため、免疫染色でのBAF250a発現消失での評価も可とされた。単剤群で10例中2例に著効(CR)が見られたがオラパリブとの併用群では10例中奏効例は見られなかった。現時点では症例数が少なくエビデンスは乏しいが、今後ATR阻害剤が治療候補となる可能性はある。(2021/10)
ATM
DNA修復機能異常に関連する遺伝子(HRD)。BRCA1/2の欄も参照。PARP阻害剤またはプラチナ製剤が候補になり得るが、最近はATMはHRR遺伝子ではあるがPARP阻害剤の有効性がそれほど高くないということからPARP阻害剤を推奨しないとする考えが主流である。
去勢抵抗性前立腺癌においては第3相PROfound試験コホートAでオラパリブがBRCA1/2またはATMに変異を有する患者でPFSが3.6→7.4ヶ月に延長(HR 0.34)という良好な成績を示した*24*25。ただし、この文献のサブグループ解析を見るとオラパリブ群に割り付けられた患者のうち予後が良好であったのはほとんどがBRCA2変異の患者であり、ATM変異の患者ではHRが1に非常に近いため、ATM変異患者に対するPARP阻害剤の有効性は(BRCA変異に比べて)あまり期待できないかもしれない。
去勢抵抗性前立腺癌に対するニラパリブのGALAHAD試験でもBRCA1/2群の奏効率が34%であったのに対して、非BRCAのHRR群では奏効率が11%にとどまり、効果が低い傾向にあった*26。しかもこの試験ではgermline mutationかbilallelic mutationのみをセレクションしており、somaticかつmonoallelicな場合の有効性はさらに低い可能性がある。
その他にATM変異陽性腫瘍に対するATR阻害剤の開発が進行中である。
リキッドバイオプシーでCHIPによるATM変異が検出される場合
組織パネル検査ではATM変異が検出されず、末梢血リキッドパネル検査のみでATM変異が検出される場合などは、クローン造血の影響を考える必要がある。つまり固形がんのctDNAを見るために実施した末梢血リキッドパネル検査が、固形がん由来のctDNAではなくCHIPを拾ってしまうケースである。ATMはCHIPでしばしば検出される遺伝子としてよく知られているが、そのほかにCHEK2、DNMT3A、KMT2D(MLL)、TP53、TET2、JAK2、ASXL2、CBL、MPL、MYD88、SF3B1、U2AF1などもCHIPとしてしばしば見られる遺伝子変異として知られている*27。なお、CHIPとして検出される場合はVAFは1%以下の低値となることが一般的である。
遺伝性腫瘍
小杉班リスト20191210ではgermline test推奨度◎だが、NCCオンコパネルのgermline対象遺伝子にはなっていなかった*28。しかし2021年春のバージョンアップからNCCオンコパネルではATMを含めた124遺伝子がgermlineの遺伝子変異を確認することができるようになった。2021/5
その他
極めて稀であるが、ホモ接合性ATM遺伝子異常がある患者では放射線治療は絶対的禁忌ということがNCCN乳癌ガイドラインに記載されている*29。しかしヘテロ接合性ATM遺伝子異常の場合は放射線治療の有害事象は特に増加しないという報告があり標準的治療を実施すべきと考えられる*30。
BAP1
悪性胸膜中皮腫などでしばしばBAP1病的変異が見られる。BAP1機能喪失変異を有する悪性胸膜中皮腫に対してタゼメトスタットの有効性の報告があり、74例参加に対して奏効は2例であり奏効率は高くはないものの数少ないながら長期に病勢制御が得られている症例もある*31*32。未確認情報ながら、その後のタゼメトスタットのBAP1に対する標的治療薬としての開発は企業の商業的判断により止まっているようである。
BAP1はBRCA1-associated protein 1の名前の通りBRCA1に関連した遺伝子であり、オラパリブの第2相試験が行われたが、germline BAP1変異4例、somatic BAP1変異8例を含む23例の悪性胸膜/腹膜中皮腫のコホートに対して奏効率は4%、PFSとOSは3.6ヶ月と有効性を示せなかった*33。なお、この試験ではgermline BAP1変異を有する群はオラパリブ治療時に有意に予後が不良であった。
BAP1を含む相同組み換え修復関連遺伝子異常を有する固形がんに対するニラパリブの単群第2相試験ではコホートAの奏効率は6%と低値であった*34。
BARD1
HRDの下流に位置する遺伝子の一つでオラパリブを始めとするPARP阻害剤が対象となる可能性はあるが、BRCA1/2やPALB2などと比べるとPARP阻害剤の有効性に関するエビデンスは乏しい(前立腺癌のPROfound試験などでもPALB2、BARD1、RAD51Dなどは片群0〜1例しか存在せず有効性の評価が不能である)。基礎的検討ではBARD1不活化状態の細胞株に対して一定の細胞増殖抑制を示すもののその影響はBRCA2に比べるとかなり小さい*35。
BMPR1A
小杉班リスト20191210では開示推奨度はAAだがT-only panelで二次的所見である頻度は高くなくgermline test推奨度は無し。
BRAF
BRAF遺伝子異常はclass I〜IIIおよびその他の分類不能に分ける考え方が一般的である*36。この分け方についてはCancer Discovのレビューがよくまとまっており分かりやすい*37。また病的意義をどの程度有するかはClinVarなどの情報も参考となる。
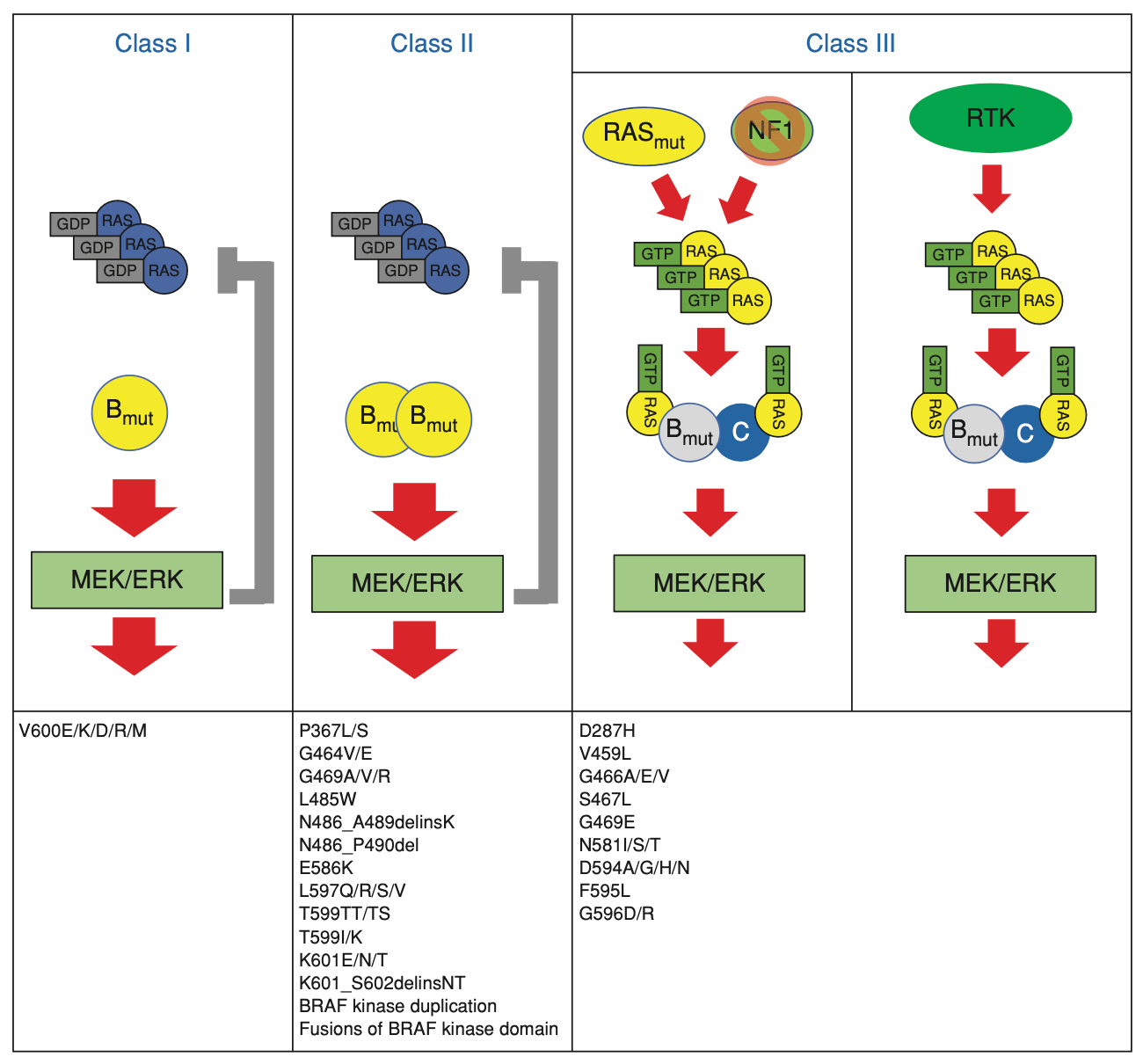
- class Iはキナーゼ活性が野生型に比べて500倍と高く、上流のRASからのシグナルとは非依存的に、単量体で下流シグナルを活性化しシグナルを発する。V600Eがキナーゼ活性が最も高いclass Iとされ、このクラスではBRAF阻害剤の有効性が高く標準治療になっている。
- class IIはclass Iとは異なり単量体では活性化シグナルを発しないが、上流のRASからのシグナルとは非依存的に野生型と二量体を形成することでシグナルを発し、そのキナーゼ活性がは野生型の数倍から50倍程度とされる。
- class IIIは野生型と同等か野生型よりもむしろキナーゼ活性が低下している。BRAFキナーゼ活性は低く、野生型BRAFまたはCRAFと二量体を形成し、二量体が上流のRASからのシグナルを受けて活性化されることで、下流のシグナルを活性化する。
- さらに、class I〜IIIのいずれにも分類されないVUSも存在している(未知の新規融合遺伝子など)。
参考文献
- 名古屋大学のグループから提示されている治療候補に関する情報 https://www.med.nagoya-u.ac.jp/medical_J/laboratory/basic-med/can-dia-an-thera/advanced-cancer-therapeutics/
- SLLIP試験の知見から見たBRAF変異非小細胞肺癌に関する レビュー https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6770188/
- 本邦からの大腸癌におけるBRAF変異のマネジメントのレビュー https://pubmed.ncbi.nlm.nih.gov/33842313/
BRAF V600E
BRAF遺伝子変異でがん遺伝子として機能するものの多くはBRAF V600E変異である。大腸癌ではSSAP由来の大腸癌でBRAF V600E変異の頻度が高い。悪性リンパ腫ではhairly cell leukemiaではほぼ全例でBRAF V600E変異が陽性であることが知られている。
- 悪性黒色腫ではBRAF阻害剤+MEK阻害剤(ダブラフェニブ+トラメチニブまたはベムラフェニブ+コビメチニブまたはエンコラフェニブ+ビニメチニブ)の併用療法が標準治療となっている。
- BRAF変異大腸癌ではフィードバック機序やCRAFなどパスウェイの迂回経路が生じることからBRAF阻害剤+MEK阻害剤の2剤併用では腫瘍を抑制できず、エンコラフェニブ+セツキシマブの2剤併用またはエンコラフェニブビニメチニブ+セツキシマブの3剤併用が必要となる(BEACON CRC試験*38)。BEACON CRC試験ではこの2剤併用と3剤併用で生存期間の有意な差は認められなかったが、腫瘍量が多い場合やCRPが上昇している場合では3剤併用を考慮する。
- 臓器横断的第2相ROAR試験では臓器を問わずダブラフェニブ+トラメチニブ併用療法が比較的良好な効果を示しており、今後はBRAF V600Eに対する標準治療になっていくであろうことを示唆する*39。(2023/4)
- 胆道癌の第2相ROAR試験では、ダブラフェニブ+トラメチニブ併用療法が二次治療であるにも関わらず奏効率47%と非常に良好な成績を示した*40。
- 非小細胞肺癌ではダブラフェニブ+トラメチニブの併用療法がPFS 10.2〜10.8ヶ月、OS 17.2〜18.2ヶ月と非常に良好な治療成績を示し、またそのPFSやOSは前治療の有無によってほとんど差が無いという特徴が見られた*41。
- 甲状腺癌(未分化癌)の20〜30%でBRAF V600E変異が認められ*42、ダブラフェニブ+トラメチニブの第2相試験は奏効率69%と良好な成績であった*43。また、国内でエンコラフェニブ+ビニメチニブの第2相試験が進行中(2021年8月)。
- 小児のlow grade gliomaではダブラフェニブ+トラメチニブ併用療法が奏効率47%と非常に良好な成績を示した*44。そのほかに、ダブラフェニブ単剤*45やトラメチニブ単剤*46の治療も有効性が報告されている。なお、小児のlow grade glioma*47でBRAF V600E変異を伴う場合はhigh grade glioma*48に近いリスクと予後推移を示すことが示唆されている。
V600K、その他のV600の変異
悪性黒色腫ではBRAF V600EとV600Kについては同等にBRAF阻害剤とMEK阻害剤の治療が標準治療と考えられる。またNCCNガイドラインではV600に起こった変異であれば(V600EやV600Kに限定せず)BRAF阻害剤とMEK阻害剤の併用療法を推奨している。
V600以外のBRAF変異
V600E以外のBRAF変異やfusionはclass IIまたはclass IIIの異常とされBRAF阻害剤の有効性は期待しにくい。NCI-MATCHのBRAF non-V600変異コホートではトラメチニブ単剤は奏効例は1/32例にとどまりネガティブとの結果であった*49。この試験ではclassIIは13例、classIIIは19例含まれておりclassIIの方がPFS・OSともに良い傾向にあったが有意な差は無かった。→BRAF classIIIの欄を参照
一方で悪性黒色腫ではトラメチニブなどのMEK阻害剤は候補となる可能性がある*50が、NCI-MATCHの結果では32例中1例しか奏効率が見られず効果は思わしくなかった*51。他にもトラメチニブやコビメチニブなどのMEK阻害剤の有効性に関する報告が散見される*52。
悪性黒色腫ではV600E以外のBRAF変異に対するBRAF阻害剤+MEK阻害剤の報告もあり、V600E以外の希少なBRAF変異にもある程度の有効性があるとの報告もある*53*54。ただし、もともとV600E以外のBRAF変異は予後が良い傾向がある*55ので解釈には注意が必要である。
大腸癌では、class I〜IIIの全てにおいてBRAF阻害剤やMEK阻害剤での治療を行う場合には上流シグナルであるEGFRを遮断する抗EGFR抗体を併用するのが標準的と考えられるが、抗class II変異にはBRAF阻害剤抵抗性だがMEK阻害剤が有効なため抗EGFR抗体+MEK阻害剤の併用療法が有効との報告もある*56*57。
大腸癌ではV600の10分の1くらいの頻度で594か596の変異があり、V600Eは「右側結腸・高齢・MSI・治療抵抗性・予後不良」な因子であるのに対して594と596はいずれも「直腸・MSS・予後良好」な因子とされる*58。
保険適用についてはベムラフェニブやダブラフェニブなどは添付文書上は「BRAF遺伝子変異を有する〜」としか書かれていないため、V600E以外でも臓器が悪性黒色腫や大腸癌などであれば保険適用での投与が可能と思われる。
classIII BRAF変異
classIIIのBRAF変異は病的意義がないため、治療標的とはならないと考えられる。
前述のNCI-MATCHのnon-V600変異陽性コホートに対するトラメチニブの第2相試験の唯一の奏効例はclassIII変異陽性(BRAF G469E)であったがこの症例はNF1不活化変異と同時に変異が生じており、また別のlong SDとなった症例もclassIII変異陽性(D594G)であったがこの症例もRASとNF1の変異も同時に存在していた。このためBRAF classIII変異に対するMEK阻害剤の有効性はBRAF変異のみで決めることは難しく、classIII変異はRASやNF1など他の遺伝子変異、またはpERK経路の活性化亢進と同時に存在することで治療に対する反応性が変動することが示唆されている*59。
BRAF fusion
BRAF fusionもBRAF阻害剤の有効性が期待しにくいBRAF異常であるがclass IIに分類されるものが多いと考えられる。しかしfusionの相手先が非コーディング領域であるなど機能喪失型のfusionと考えられる場合には、そのBRAFを薬剤で阻害しても抗腫瘍効果が期待できないため、治療対象とならない。治療標的であるための必要な条件は幾つかあるが、FoundationOne CDxのレポートで読み取れる範囲で判明する最低条件としてXMLファイルに記載されたin-frameがYESであることや遺伝子の活性ドメインを含む結合であることなどが挙げられる。
BRAF融合遺伝子に対してはBRAF阻害剤+MEK阻害剤の有効性のエビデンスは少数のみある。報告としてはKIAA1549-BRAFのfusionが多いが、fusionの相手となる遺伝子は多岐にわたる*60。BRAF活性化につながる病的意義があると判断されればMEK阻害剤が単剤で有効との報告はある。
BRAF増幅
BRAF V600E変異に対するBRAF阻害剤+MET阻害剤による治療を行っている課程で出現する耐性変異としてBRAF増幅が見られることがしばしばある。ここから考えてもBRAF増幅に対するBRAF阻害剤は推奨されにくい。
BRAF indel(挿入/欠失)
BRAFのindelは部位により判断が異なるが活性化に影響しうる場合はBRAF classII変異と考えられ、BRAF阻害剤+MEK阻害剤の併用療法が対象となると考えられる。
中でもN486-P490の欠失を持つ膵癌に対してBRAF阻害剤ダブラフェニブが著効したとの報告*61があり、また他の癌腫でも同領域の変異に関するMEK阻害剤トラメチニブの有効報告*62がある。またBRAF阻害剤の有効性に関する有効性を検討した報告がある*63。K57_G61の欠失についても報告*64がある。
BRCA1/BRCA2
HRD遺伝子の1つ。HRD遺伝子にはBRCA1/BRCA2のほかに、CHEK2、ATM、CDK12、PPP2R2Aなどがある。
BRCA1/BRCA2の以上に対してはPARP阻害剤オラパリブが良い適応で、乳癌(アンスラサイクリン・タキサン既治療でgBRCA異常あり)または卵巣癌(プラチナ感受性またはgBRCA異常あり)ではすでに保険適用されている。前立腺癌や膵癌での承認も期待されている。また2020年9月に卵巣癌に対してニラパリブも承認された。PARP阻害剤が保険適用でない臓器の場合は同じく相同組み換え修復異常を標的とするプラチナ系抗腫瘍薬も候補になる。
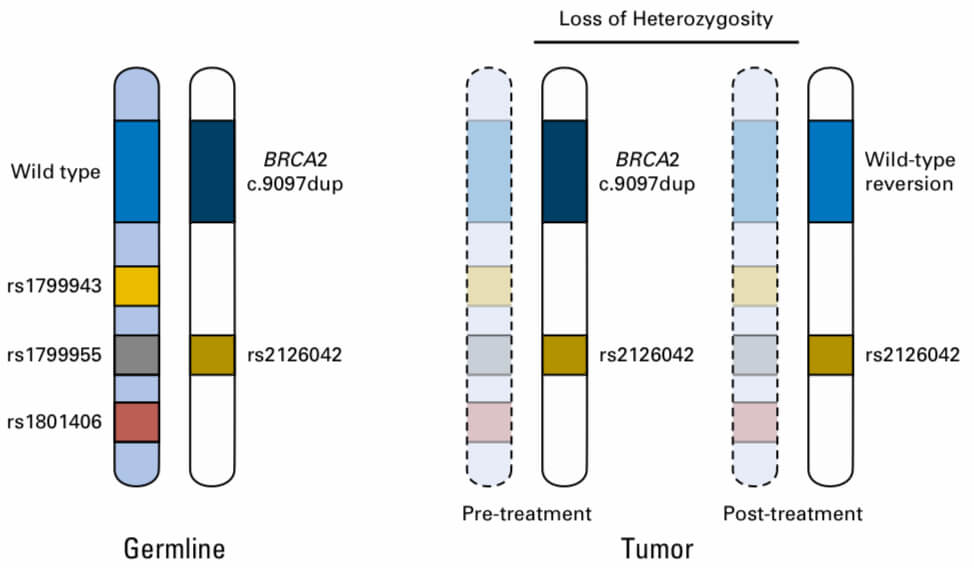
BRCA異常は特に若年乳癌・若年膵癌などで変異が見られる頻度が高い遺伝子異常だが、gBRCA膵癌に対するPOLO試験の検討からgBRCAがある患者に対するオラパリブは年齢によらず高齢でも有効性があることが示唆されている*65。
変異やframeshiftが主でClinVarでデータベースが数多く収載されている。ミリアドはBRCAにhg38(GRCh38)とは異なる塩基番号を振っているため、BRACAnalysisとパネル検査のBRCA1変異塩基番号はずれていることに注意が必要(BRCA2はこの問題はない)。※最近この問題は解決された? 2022/9
プラチナ感受性との関連
プラチナ系抗腫瘍薬とPARP阻害剤の感受性は連動していることが多く、PARP阻害剤を使用する場合はプラチナ系抗腫瘍薬に抵抗性になる前に治療開始することが望ましい。膵癌や卵巣癌ではプラチナ系抗腫瘍薬の治療歴があり感受性を認めた患者のみを対象とした治療開発が主であるが、前立腺癌や乳癌は必ずしもこの通りではない。
卵巣癌においてはプラチナを含む3レジメン以上の化学療法を受けた症例に関しても奏効率30%、DoR 8ヶ月という成績を示した報告*66、*67もあり、特にgermline BRCA変異の場合はプラチナ化学療法でPDとなってもPARP阻害剤が有用なケースは一部には見られると考えられている。卵巣癌などではプラチナ不応・耐性の腫瘍に対する新規PARP1阻害剤の臨床試験なども実施されている。たとえばプラチナ既治療不応例を70%程度エントリーしたPETRA試験*68などがそれにあたり、今後はそれらの報告が相次ぐと考えられている。
BRCAの融合遺伝子(fusion)や染色体再構成(rearrangement・truncation)
まれながらBRCAと他のfusionが報告されているとのことだが、BRCA fusionに対する治療は報告が極めて少ない。また、極めて報告数が少ない変異のためBRACAnalysisやMyCoiseではVUSと判断されることが少なくないようである。
二次的所見(HBOC:遺伝性乳癌卵巣癌症候群)
遺伝性乳癌卵巣癌症候群(HBOC)の原因遺伝子。特に、若年乳癌、卵巣癌、膵癌、前立腺癌などに関与する。これらの家族歴をよく聴取することが重要となる。二次的所見が疑われる場合は積極的に遺伝カウンセリングを考慮する。小杉班リスト20191210では開示推奨度は最上級のAAAであり、germline test推奨度も◎。なお、予防的子宮付属器切除が保険適用となる(2020〜)。
乳癌
タキサン・アンスラサイクリンの治療歴がある場合はBRCAnalysisが保険適用で実施可能であり、病的変異を認めればオラパリブが保険診療で実施可能。
germline BRCA変異を有するTNBCに対するベリパリブがBROCADE3試験のサブ解析でPFS延長を示した*69。
プラチナ感受性卵巣癌
プラチナ感受性卵巣癌については保険診療であり標準治療。
なお、プラチナ抵抗性卵巣癌であってもgermline BRCA変異があればある程度の感受性があるとの報告がある*70。従来はプラチナ抵抗性卵巣癌の後治療化学療法は奏効率15%程度であるとされているのに対してオラパリブは30%程度あると考えられている。
膵癌
PARP inhibitors in pancreatic cancer: molecular mechanisms and clinical applications(レビュー2020年3月)
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-020-01167-9
前立腺癌
BRCA1/2・ATM・FANC family・CHEK2を含むDNA修復異常についてはPARP阻害剤が候補。第2相試験で有望な結果あり*71。
米国ではBRCA1/2変異を有する進行前立腺癌に対してルカパリブが迅速承認された*72。単群試験TRITON2試験の結果に基づくもの。迅速承認時点での奏効率は44%、奏効期間は未到達。
またBRCA1/2またはHRD陽性の去勢抵抗性前立腺癌ではルカパリブ+ニボルマブの併用療法の有効性がESMO2021で発表され、今後は免疫チェックポイント阻害剤も併用されるようになる可能性がある*73。
胆道癌
胆道癌は比較的BRCA1/BRCA2の病的変異が検出されやすい腫瘍で、またPARP阻害剤の有用性が期待される腫瘍であるが、確立された治療にはなっていない*74。2024/3
大腸癌
ベリパリブ+テモゾロミドの第2相試験
オラパリブの第2相 Oncologist
gBRCAとsBRCAで奏効率に差があるか
前立腺癌に対するルカパリブ第2相試験(TRITON2試験*75)の結果ではgBRCAとsBRCAの間で奏効率に差は見られなかった。
PARP阻害剤の放射線増感作用
BRCA変異を有する有さないに関わらず、PARP阻害剤は1本鎖DNA切断を生じた細胞に対する細胞死誘導の効果があるため放射線治療の増感作用があると考えられ、これに関する臨床試験が頭頚部癌などで行われている*76。
BRIP1
BRIP1はファンコニ貧血関連遺伝子の1つであり、germline BRIP1の機能喪失型バリアントを持つ場合は卵巣癌リスクの増大に関与する事が知られており*77、PARP阻害剤やプラチナ系抗腫瘍薬が推奨されることがある。
CCND1、CCND3
CDK4/6阻害剤
アベマシクリブ、パルボシクリブなどが候補と考えられていたが、NCI-MATCHの結果からは36人のCCND増幅固形がん(うち1例のみCCND3増幅で他は全例CCND1増幅。対象臓器は23種類)の患者に対してパルボシクリブを投与した際の奏効率が0%であったとの報告がされている*78。したがってCCND1増幅に対するCDK4/6阻害剤の効果への期待はあまり高くないかもしれない。なお、ホルモン感受性乳癌でCCND1増幅を認めた場合は内分泌療法剤+CDK4/6阻害剤の併用療法を未使用であれば(genome-based治療ではなく標準治療として)実施を検討すべきである。
CCNE1
子宮内癌や卵巣癌などでも変異の報告が多い。CCNE1増幅とFBXW7変異の同時出現は子宮癌肉腫などでしばしば認められる*79。
CCNE1増幅陽性の上皮性卵巣腫瘍などに対するWEE1阻害剤アダボセルチブの開発が進んでいる*80。CCNE1増幅はPKMYT1阻害により合成致死を示すという報告*81があるが、PKMYT1を標的とした治療薬の開発はまだ進んでいない。
CD274 (PD-L1)
CD274はPD-L1の別名。
PD-L1増幅(gain)・喪失(loss)
免疫染色PD-L1陽性は非小細胞肺癌のほかに多々の腫瘍で有効性が確認されているが、遺伝子増幅と免疫染色は一致する傾向にある*82が同値ではないのでPD-L1増幅があった場合には免疫染色も確認してみる価値がある。SAFIR02-BREAST IMMUNO試験によると、CD274の増幅がある非小細胞肺癌では化学療法よりもデュルバルマブによる維持療法の有用性が高い(CD274増幅がない場合OS HR 1.12に対して増幅がある場合はOS HR 0.18)と報告されている*83。
免疫チェックポイント阻害剤の場合は患者申出療養にエントリーできる可能性がある。
PD-L1のコピー数が増えてように見えて実際にはamplification(増幅)を伴わずpolysomy(多数倍数体)の腫瘍細胞となっているだけのことがあり、この場合はPD-L1コピー数が高くても免疫チェックポイント阻害剤の奏効率は高くならないという報告がある*84。FoundationOne CDxのレポート上ではamplificationとpolysomyの区別は難しいと思われる(?)が、polysomyの場合はコピー数比があまり高くなりにくいのでintermediateと報告されることが多いと思われるため実際の運用上は問題となることは比較的稀と思われる。また別の報告*85でもPD-L1のlossは明確な予後不良因子である一方でコピー数増幅(gain)は予後良好との関連は乏しそうな傾向がある。
リキッドバイオプシー(FoundationOne Liquid CDx)の場合は増幅は薬事承認の対象外となっているため、CD274の増幅をICI治療のバイオマーカーと考えてよいかどうかには議論の余地がある(公的な見解は出ていないと思われる)。(2022/4)
PD-L1 rearrangement
PD-L1 rearrangementを有し免疫染色でもPD-L1高発現があった卵巣癌がペムブロリズマブの投与によってCRとなった症例報告がある*86。rearrangementによってPD-L1の発現が異常亢進したことが有効性の前提となったと考えられるので、PD-L1の高発現を伴わないPD-L1 rearrangementでは免疫チェックポイント阻害剤が有効かどうかは定かでなく、免疫染色での裏付けを確認することが望ましい。
CDH1
治療薬候補は無し。ただし基礎的研究からCDH1変異細胞株に対するROS1阻害剤の有効性が示唆される*87ため、CDH1変異腫瘍を対象としたクリゾチニブの第2相試験が行われた*88が、現時点ではまだ有効であるとの報告はない(2023年4月現在)。
遺伝性胃癌の原因遺伝子。ただし胃癌の場合は悪性度の高い未分化癌・低分化癌になる傾向あり。CDH1病的変異を有する場合はびまん性胃癌をおおむね40歳頃までに発症する*89。H.pylori陽性・分化型胃癌などではCDH1の関与の度合いは低い。若年かつH.pylori陰性・びまん型胃癌の家族歴を有する場合は開示を積極的に考慮する。
乳癌においては組織型が浸潤性小葉癌(invasive lobular breast cancer)の場合にCDH1変異が一定割合で見られるという報告がある*90。
小杉班リストver2では開示推奨度はAA、germline testの必要性◯。
なお、CDH1はFoundationOne CDxには解析対象遺伝子に搭載されているが、NCCオンコパネルには搭載されていないので、遺伝性胃癌を疑う症例で二次的所見の有無を検討する際には使用しているパネルの種類に注意を要する(2021/8時点)。
CDK4、CDK6
CDK4増幅陽性の高分化型または脱分化型の進行脂肪肉腫に対してはCDK4/6阻害剤パルボシクリブ(PD0332991)の単群第2相の試験がある*91。これによると12週PFSは66%でPFS中央値は18週で奏効例は30例中1例であり奏効率が低いが、この試験の主要評価項目(12週PFS>40%をpromisingと判定するとデザインされていた)はmetしている。主要評価項目をmetしているということでこの治療候補を有用とするか奏効率が低いと考えるかは判断がわかれるところ。また脂肪肉腫ではCDK4の増幅がしばしば見られ、これに関してのレビュー文献がある*92。
HR陽性乳癌以外の臓器についてはエビデンスが非常に乏しいために、HR陽性乳癌と上記の脂肪肉腫を除いた腫瘍に対してCDK4/6阻害剤を推奨できるかどうかは判断が難しい(2020.8)。
CDK12
HRD関連遺伝子の1つであるため、機能喪失性変異などの場合はPARP阻害剤やプラチナ製剤が候補になり得ると考えられていた。しかし去勢抵抗性前立腺癌に対するオラパリブのPROfound試験*93ではCDK12変異を含むコホートBでのOS改善はごくわずかであることなどから、2022年半ばからはC-CATではBRCA1/2およびPALB2以外にはPARP阻害剤が「推奨されない」ようになっているようである(FDAはコホートB変異についても承認をしている*94)。
その他にCDK12変異陽性去勢抵抗性前立腺癌ではペムブロリズマブの有効性が高い可能性が報告されており*95、その理由としてCDK12変異ではfocal tandem duplicationが増加しネオアンチゲンの増加につながると考察されている*96が、この前立腺癌の報告以外にはあまり報告がないため前立腺癌以外でCDK12変異があるという理由で免疫チェックポイント阻害剤を推奨できるだけのエビデンスは十分ではない。またCDK12変異が単アレルではなく両アレル変異に起こっていないとネオアンチゲンの増加に寄与せず免疫チェックポイント阻害剤のバイオマーカーとならないと考える意見もある*97。さらに、CDK12不活化前立腺癌に対してニボルマブ+イピリムマブ併用の単群第2相試験がASCO-GU2022で発表されており、28人中6人にPSAの低下を認めた*98。前立腺癌以外についても後方視的記述研究で免疫チェックポイント阻害剤の有効性を示唆する報告*99がある。
中国からの報告によると、欧米人に比べてアジア人では去勢抵抗性前立腺癌のCDK12変異の頻度が高く(欧米人5-7%、中国人15%)、またCDK12はPARP阻害剤や免疫チェックポイント阻害剤だけでなくドセタキセルで治療した際の予後も良い可能性がある*100。
CDK12増幅の場合は推奨治療なし。
CDK12に対する標的治療のレビュー*101が掲載されている。
CDKN2A/CDKN2B
有望な治療薬は乏しい。アベマシクリブ、パルボシクリブなどのCDK4/6阻害剤が推奨されていたこともあるが、有力な候補としての根拠は乏しい。
臓器毎のCDK4/6阻害剤
胆管癌・膵癌
- TAPUR試験ではCDKN2A lossまたはmutationを有する胆管癌・膵癌に対するCDK4/6阻害剤は否定的な結果であったとの結果が2019年に報告された*102*103。
- 胆膵系への有効性は否定的と考えられている。
非小細胞肺癌
- 非小細胞肺癌ではCDKN2A alterationを有する29症例に対してパルボシクリブを投与した中で奏効例(PR以上)が1例見られたとの報告がある*104。なお、症例数は少ないながらCDKN2A mutationに対する有効性は低いのに対してCDKN2A lossに対しては病勢制御できる症例が若干多く見られる傾向であった。
- TAPUR試験ではSD以上で有効と判定し、28例投与して7例でSD以上であれば試験としてはポジティブであると判断されるため、臨床試験自体は非小細胞肺癌に対する評価はポジティブであると評価されている。
- 2020年8月時点のC-CATレポートでは推奨度Eとなっている。
- KRAS変異と合併する場合はKRAS変異がPI3K阻害剤の耐性を生むのではないかと考えられるが、この論文で引用されている報告によるとアベマシクリブ単剤の第2相試験でのDCRはむしろKRAS変異陽性の症例で高かったと記載されている。
頭頚部癌
- TAPUR試験の頭頚部癌コホートでは奏効率は0%であったが16週SDを維持した症例が28例中10例(37%)である*105(TAPUR試験では28例中7例が奏効すれば次段階の開発に進むと定義され、ポジティブと判断されている)。したがって頭頸部癌に関してはパルボシクリブが推奨されることがある。
- PFSは9.4週、OSは41週であったが、頭頚部癌としてはPFSに対してOSが長いため、かなり進行が緩徐な腫瘍を対象としたデータである可能性がある。
軟部肉腫
- TAPUR試験のCDKN2A軟部腫瘍コホートは1例を除き全例が脂肪肉腫であり、CDKN2Aの変異タイプは全例がamplificationであったが、病勢制御率が47%でPFSは16週であった。CDKN2A lossに対するデータは少なく、脂肪肉腫を含む軟部肉腫に積極的にCDKN4/6阻害剤を推奨する根拠は乏しい。
尿路上皮癌
- 尿路上皮癌は多段階発癌の過程として、筋層浸潤癌になる段階でCDKN2Aの変異または欠失を獲得することがしばしばある。また悪性黒色腫も転移性になったものは2割程度がCDKN2Aに異常を有しているとされる。このように腫瘍の種類によっては発癌後に早期癌から進行癌に進展する時点でCDKN2Aの異常を獲得することが少なくない。
- 尿路上皮癌ではCDK4/6阻害剤の奏効を予測するバイオマーカーとは考えられていない。
悪性胸膜中皮腫
- プラチナ既治療の悪性胸膜中皮腫ではCDKN2A-MTAPのlossによりp16ink4a陰性となる頻度が高いが、p16ink4a陰性中皮腫ではアベマシクリブの有効性がやや高いとの報告がある*106。ただしこれはpost hoc解析の結果であり、奏効例は3/26例、腫瘍径変化率中央値は0%に留まり、バイオマーカーで選別しても有効性が高いとは言い難い。
総じて、CDKN2Aに対してパルボシクリブやアベマシクリブが治療選択肢として候補となる可能性はあるものの、奏効例はほとんどないことから、標的治療として有効性がかなり期待できるとまでは言いにくい印象である。少なくともCDKN2AはCDK4/6阻害剤の質の高いバイオマーカーとは言えない。ただし、非小細胞肺癌と頭頚部癌にはTAPUR試験の判断基準ではポジティブであるとされている。患者申出療養の対象となるかどうかは、がんゲノム医療中核拠点病院で判断される(中核拠点病院によって判断が異なる可能性がある)。
二次的所見
ACMG59リストには含まれないが、小杉班リストでは開示推奨度A、germline test必要性◯となっている。しかし実際にはパッセンジャー変異のことが少なくない印象。悪性黒色腫に関してはCDKN2Aによる遺伝性発癌の可能性を検討する必要がある*107。
CHEK2
DNA修復機能異常に関連する遺伝子(HRD)。BRCA1/2の欄を参照。
悪性黒色腫や膵腫瘍に関連あり。開示推奨度A、germline test必要性◯。
CSF1R
TAPUR試験ではスニチニブが候補と考えられている*108。
CTNNB1
エベロリムス+レトロゾールの併用療法が有効な可能性がある。
DICER1
小児胸膜肺芽腫の原因遺伝子で遺伝性腫瘍に関連する*109。
EGFR
EGFR-TKIの治療対象となるが、その変異部位によって感受性が大きく変わる。これまでにCOSMICには約600種類のEGFR遺伝子異常が報告されているが、その93%はチロシンキナーゼドメインであるエクソン18-21の範囲に見られる。とくにEGFRエクソン19のコドン E746〜A750の欠失変異およびL858R(エクソン21)に変異がある頻度が高い*110。そのほかにL747-E753へのS挿入、L747-E751欠失、L747-E750欠失+P挿入、G719X(Xは様々)、E709X、S768I、L861Qなどの変異がある。
高感受性変異
エクソン19欠失変異
EGFR変異の約40-45%を占める。L858R変異に比べて相対的に若年者・喫煙者に見られることが多い。EGFRの活性化変異でありEGFR-TKIの最も良い適応となる。
L858R変異
EGFR変異の約40%を占める。EGFR-TKI感受性はエクソン19欠失変異に次いで高いグループ。
NEJ026試験(エルロチニブ+ベバシズマブ)やRELAY試験(エルロチニブ+ラムシルマブ)で血管新生阻害剤との併用の有用性が示されたが、サブグループ解析ではL858R変異群で併用例のPFSが良好であった。
中間感受性群
EGFR-TKIの中でも薬剤により感受性が異なる。
G719X
まれな遺伝子変異。第1世代EGFR-TKIは効果が乏しい一方で、LUX-Lung 2,3,6試験の統合解析から第2世代EGFR-TKI(アファチニブ)は比較的効果が高い。
S768I、L861Q
まれな遺伝子変異。第1世代EGFR-TKIは効果が乏しい一方で、アファチニブとオシメルチニブは比較的効果が期待される群。
耐性変異
T790M
ゲフィチニブ、エルロチニブなどの耐性変異となる遺伝子変異である。初期治療前から存在している一次的変異と、EGFR-TKIによる治療の経過中に生じた二次的変異で扱いが多少異なる。EGFR-TKIによる治療中に生じた耐性の50-60%はT790M変異とされる。二次的変異の場合は耐性変異オシメルチニブが候補。
ロシレチニブ、オルムチニブなどオシメルチニブ以外の第3世代EGFR-TKIはいずれも毒性などのために開発が中止された。ほかにアビチニブ(アヴィチニブ)、EGF816など。
EGFR エクソン20挿入変異
EGFR阻害剤の臨床試験ではEGFRエクソン20異常の症例は除外されているのでEGFR変異肺癌の中でエクソン20異常症例に関するエビデンスは少ない。EGFR変異の5-6%に見られるとされている。EGFR-TKI(特にエルロチニブ・ゲフィチニブ)への耐性を示す。
中にはオシメルチニブが奏効するサブタイプもあるという6例の症例報告がある*111が、基本的にはオシメルチニブに関してもexon20挿入は耐性と思われる。一方でオシメルチニブ高用量(160mg)での有効性が報告され治療開発が進められている*112。ほかにTAK-788などいくつかexon20を標的にした治療開発が進んでいる*113。
エクソン20挿入変異の全てがEGFR-TKIに耐性変異というわけではないことも知られている。たとえばEGFR-A763_Y764insFQEAという特定の4コドン挿入はEGFR-TKIに高感受性である*114*115。またH773L/V774Mの2塩基変異は第1・2世代EGFR-TKIには耐性だがオシメルチニブは著効するという報告がある*116*117。これはcompound mutationなどと称されることもある。EGFR変異のうち15%程度を占めるが特にコバスやオンコマインDXなどで検出できないレア変異は5%程度ではないかと推定され、これらを見つけるためにFoundationOne CDxなどを検討する価値がある。近年はEGFR変異を塩基別に検討するのではなく立体構造で分類することの重要性が言われるようになっている*118。
オンコマインDX target testマルチCDxはエクソン20挿入変異をシークエンスしているがレポートには含まれないものがあるので解釈に注意を要する(これについては2020年春からレポートに含まれるようにバージョンアップされる見込みとのこと)。オンコマインDXが検出できるEGFR変異のリストは添付文書に掲載されている*119。
モボセルチニブが既治療のEGFRエクソン20挿入変異陽性に対して2021年9月にFDA承認された*120。またこのコンパニオン診断は現時点ではFoundationOne CDxではなくオンコマインDxとなっている。奏効率は28%、OSは約24ヶ月と成績良好であった*121。しかし米国で迅速承認後にEXCLAIM-2試験で有効性の再現ができなかったことから、2023年10月にモボセルチニブの販売が中止されている*122。EXCLAIM-2試験の結果は今後発表される(2023年10月時点情報)。
EGFR exon20変異およびERBB2 exon20変異に対するポジオチニブ第2相試験が進行中*123。これはexon20に病的変異を持つEGFRとERBB2が病的ダイマーを形成し機能異常を来すことに対する特異的阻害剤である。国内でも試験が進行中である*124。
ジパレルチニブも第1/2相試験で一定の有効性を示しており2022年にFDA breakthroughの指定を受けており*125、国内でも治験が進行中である。2023/10
L833V、A839T、V851I、A871T、G873E
まれなEGFR変異。いずれもEGFR-TKI耐性に関連するとされている。L858R変異の12.8%に合併して起こりゲフィチニブ耐性となる1次的変異のことがある*126。
そのほかにEGFRの耐性機序としては以下のようなものが考えられている。
- MET増幅
- HER2増幅
- PIK3CA変異*127
- BRAF V600E変異
- MAPK1増幅
- PTEN発現喪失
- CRKL増幅
- HGF過剰発現
- 小細胞癌・未分化癌への形質転換(RbやTP53に不活化があるEGFR変異陽性肺癌でしばしば見られる)
- EMTの発生(AXL活性化、MED12発現喪失、TGFbやIL6のパスウェイの異常など)
RET融合遺伝子の新規獲得はEGFR-TKIに対する耐性範囲であるが、EGFR変異とRET融合遺伝子が共存在する肺癌にオシメルチニブ+セルペルカチニブ併用療法が有効という報告がある*128。
オシメルチニブ耐性変異
T790M変異肺癌に対するオシメルチニブ耐性変異の22%にC797SやC797G(C797Xとも表記される)が、68%にT790Mのlossが見られるとの報告がある*129。C797XとT790Mの変異がcis/transのどのような関係にあるかによって耐性に違いがあるという報告もある*130。C797X変異はオシメルチニブ以外のEGFR-TKIの変異にもつながる。エビデンスレベルは低いながらC797X変異に対してはブリガチニブとEGFR抗体の併用が有効である可能性が報告されている*131ものの、C797Xに対する創薬が困難であるとの指摘もある*132。
G796S, V802F, T725M, Q791L/H, P794S/Rなどもオシメルチニブの結合性を著しく低下させる耐性遺伝子変異であるとの報告がある*133。
T790M-lossは早期にオシメルチニブに耐性となった症例で見られることが多いことから二次的変異というよりももともと存在していたマイナークローンである可能性がある。
V441D, V441G
セツキシマブ・パニツムマブなどの抗EGFR抗体の耐性変異として知られている*134。
脳転移病変の扱い
EGFR-TKIはいずれも中枢神経移行性は高く脳転移への有効性も報告されているが、中でもオシメルチニブは非常に優れた中枢神経移行性を示す。
EGFR変異陽性+PD-L1発現陽性
1次治療としてペムブロリズマブを投与した第2相試験で奏効例がなかったことから無効中止となった*135。
EGFR増幅
FISHなどでEGFR変異が陽性の場合はEGFR-TKIの有効性と改善したとの報告がある*136が、肺癌での知見によるとEGFR増幅が見られる症例ではEGFR変異を背景にともなっていることが多いことに加えてEGFR増幅で層別化しても有効性に差がないことからEGFR増幅はEGFR-TKIのバイオマーカーとは考えにくい*137との報告がある。EGFR増幅はむしろEGFR-TKIに対する耐性機序となり得るとの報告もある*138。このことから、EGFR変異を伴わないEGFR増幅については慎重に解釈する必要がある。
肺癌ではIPASS試験のバイオマーカー研究などから、現在ではFISHなどでEGFR増幅を評価するよりもEGFR変異のほうがEGFR-TKIの有効性に関係する優れたバイオマーカーであると考えられている。またEGFR増幅のみでEGFR変異がない場合にはゲフィチニブの奏効例が0例だったという報告もある。
なお、非小細胞肺癌ではネシツムマブ(ポートラーザ)がSQUIRE試験の結果からGEM+CDDPとの併用で保険承認されている*139。この報告の中で、ネシツムマブはSQUIRE試験のサブ解析でEGFR発現expression高値(H-score≥200)の群ではさらに有意にOSを延長しておりEGFR高発現の症例ではより効果が期待できるかもしれない(発現と増幅は同値ではないことに注意)。
食道腺癌・胃癌に関してEGFR増幅がある症例では抗EGFR抗体セツキシマブが有用だったという報告はある*140が、この報告ではcopy numberの中央値が40で最大は375と極めてコピー数が高かったため、コピー数が高い増幅でなければ効果が期待できないかもしれない。
EGFR増幅に対してはセツキシマブやパニツムマブなどの抗EGFR抗体などが試みられたことはあるが、現時点ではEGFR増幅に対する抗EGFRモノクローナル抗体による治療はコンセンサスを得ているとはとは言えない。ただし乳癌(triple-negative)では11コピー数で奏効したとの症例報告がある*141。
EGFR増幅を有する上部消化管腫瘍については光免疫療法の治療開発も進行中とのことで、国立がん研究センターなどで治験を募集していることがある。臓器により異なるので確認が必要。
その他のEGFR変異
これまでにも多数の報告があり、意義不明のものもある。
転座・融合・再構成などはEGFRの活性化が推測される場合以外は治療推奨はされないと考える(たとえばfusionの相手がイントロンなど)。
EGFR vIII variant
EGFR vIII variantはEGFRのスプライスバリアントの1つでEGFR活性化変異と考えられている。脳腫瘍(glioblastoma)でしばしば見られる変異である。
EGFR-TKIが有効な可能性については基礎研究のレベルでは報告がある*142が、かなり古い基礎研究でありその後の臨床応用の情報も乏しいため、実用化されているとは言いがたい。第3世代EGFR-TKI(オシメルチニブ)が有効なのではないかという動物実験*143もあるがEGFR vIII variantを標的としたヒト臨床試験の十分なエビデンスは無い。脳腫瘍(glioblastoma)でオシメルチニブ+ベバシズマブ併用療法の有効性を見た報告はあるが比較試験ではなくその評価は難しい*144。
EGFR vIIIは細胞外ドメインIと細胞外ドメインIIを喪失していることから抗EGFR抗体の結合部位が喪失されているためセツキシマブやパニツムマブなどの抗EGFR抗体は無効であると考えられていたが、抗EGFR抗体が結合可能であるという報告もある*145。しかし結合可能であるだけで腫瘍抑制効果を示さないという報告もあり*146、いずれにせよ抗EGFR抗体は推奨治療とはならない。
他の遺伝子の変異と重複する場合
EGFR変異はKRAS・HER2・ALK転座・ROS1転座とは相互排他的(mutually exclusive)であるので同時に発生することは基本的にないが(治療中の二次的変異はある)、PIK3CAはEGFR変異と相互排他的ではない。またEGFR・PIK3CAにともに変異がある場合はPIK3CA変異はゲフィチニブの有効性に大きな影響は無いことが多い。
EP300
有望な治療薬は少ない
EPCAM
EPCAMはミスマッチ修復遺伝子ではないが生殖細胞系列で欠失が見られた場合にはリンチ症候群を考慮すべきであると考えられている*147(massiveな欠失の場合は変異アレル頻度の解釈を慎重に行う必要がある)。欠失の場合は開示推奨度AA。
ERBB2(HER2)
ERBB2増幅
判定方法
ERBB2のコピー数増幅のカットオフ値は他の遺伝子と若干異なることが固形癌HER2病理ガイダンス2022年版に記載されている*148。2022年時点の情報では、FoundationOne CDxでは通常の遺伝子増幅のカットオフ値は2倍体の場合は6コピー以上で、3倍体・4倍体などの場合は腫瘍の倍数性+4コピー以上であるのに対して、ERBB2だけは2倍体の場合は5コピー以上で、3倍体・4倍体などの場合は腫瘍の倍数性+3コピー以上とされている*149。ERBB2の変異や増幅が検出された場合は組織でのHER2 IHCも確認を行っておくことを検討する。
増幅があってもHER2がIHCで陽性とならない場合も、HER2 IHCで強陽性でもERBB2増幅がないこともありえる。NCCNガイドラインでは、NGS検査でERBB2増幅がある場合はIHCまたはFISH/DISHでERBB2陽性を確認すべきと記載されている(2020/8)。また、KRAS活性化変異が併存している場合は抗HER2療法に対する耐性がある可能性が高いので注意する(大腸癌など多くの癌腫では抗HER2薬の臨床試験でKRAS変異陽性例は除外されている)。
ERBB2増幅に対する治療
2024年4月にDESTINY-PanTumor02*150・DESTINY-Lung01*151・DESTINY-CRC02*152などの結果から臓器横断的HER2(3+)の固形癌に対してトラスツズマブデルクステカン(T-DXd)がFDA承認を取得した*153。しかしこれはNGSでのamplification(増幅)に対する承認ではなく免疫組織化学染色での過剰発現(overexpression)に対する承認であることに注意する。全体(HER2 3+と2+FISH陽性)の奏効率は51.4%であったが、3+では60%を超えていたのに対して2+は27%前後と低く、臓器横断的承認はHER2(3+)のみとなっている。承認量は乳癌などと同じ5.4mg/kgである。
- トラスツズマブ、ラパチニブなど抗HER2薬は多々あるが、ERBB2増幅例に対するトラスツズマブ単独は基本的に推奨されない(ゲノムの増幅ではなく蛋白質レベル(免疫化学染色)でHER2強陽性の場合に保険適用外の自費診療で治療を行うかどうかは各施設の判断による)。なお、コピー数が極めて多い場合(およそ50倍以上)の場合はトラスツズマブの投与が検討されることもあるがエキスパートパネルの判断によることになる。
- トラスツズマブについてはバイオシミラーも発売されており保険外診療の場合にも経済的負担を抑えることができる。
- HER2陽性固形がんに二次治療で臓器横断的にトラスツズマブ+ペルツズマブを投与した第2a相MyPathway試験が実施されており、臓器別に発表されている。唾液腺癌(奏効率60%)*154、大腸癌(奏効率32%)*155、胆管癌(奏効率23%)*156など。なお、この大腸癌コホートのデータでもKRAS変異陽性大腸癌では抗HER2療法の奏効率が低いことが示されている(PFSでKRAS野生型5.3ヶ月 vs. KRAS変異型1.4ヶ月 )。
- トラスツズマブ+ペルツズマブの第2相JUPITER試験はコピー数8以上で対象となるが、募集が終了したとのこと(2020年8月)。
- Guardant360でもERBB2増幅が認められた場合はトラスツズマブデルクステカン(DS-8201a)に対する臓器横断的試験(HERALD試験)が実施されている*157(2021年1月時点の情報)。大腸癌では募集終了しているとのこと。また肉腫では参加できない??
ERBB2増幅肺癌
非小細胞肺癌のHER2増幅/過剰発現/変異(特にエクソン20)への標的治療に関するレビューが詳しい*158。
ERBB2増幅婦人科癌
婦人科癌に対するT-DM1の第2相、Ann Oncol 2019?
ERBB2増幅大腸癌
トラスツズマブ+ペルツズマブ、トラスツズマブ+ラパチニブが治療候補となる。大腸癌の場合はトラスツズマブ単独では効果が乏しいと考えられる。
ERBB2増幅胆道癌
比較的抗HER2抗体の有効性が高いと考えられている。なおHERALD試験では胆道癌は除外されている。
ERBB2発現膵癌(免疫染色)
DESTINY-PanTumor02はおおむね臓器を問わずHER2陽性固形癌に対してT-DXdが高い効果を示したが、膵癌に限ってはHER2(3+)で奏効率0%、全体でも4%と極めて効果が乏しい傾向にあり、特に最初の15例で奏効例が1例も出なかったために膵癌コホートの募集は途中で打ち切られ、最終的に25例のエントリーに止まっている*159。
HER2陽性膵癌に対するカペシタビン+トラスツズマブ併用療法は標準治療を上回るものではなく、HER2陽性膵癌は推奨されがたいとの報告がある*160。この報告の中での考察によると、膵癌では免疫染色のHER2陽性とNGSでのHER2増幅の相関率は乳癌・胃癌などと比べて低いと考えられている。
ERBB2活性化変異
ERBB2の活性化変異は増幅・過剰発現と明確に区別する必要がある。増幅と異なり活性化変異の場合はトラスツズマブをはじめとするモノクローナル抗体による抗HER2療法は一般にERBB2変異には効果が乏しいと考えられる一方で、HER2-TKIは一定の有効性があると考えられている。ただし、ERBB familyの下流にあるRAS-RAF経路などに活性化変異がある場合はHER2-TKIの有効性も期待しにくい。
トラスツズマブデルクステカン(T-DXd)
非小細胞肺癌では第2相試験でERBB2活性化変異に対するT-DXdの有効性が確認され、ESMO2021で報告されNEJMにも掲載された*161。
乳癌・胃癌・非小細胞肺癌以外では、ERBB2活性化変異を標的とした治療の有望候補としてT-DXdの開発が進められており国内でも国立がん研究センター中央病院、同東病院、阪大病院などで第2相試験が進行中である(2021/10)。この活性化変異は下記の12の遺伝子変異のことを指している*162。
治療標的となるERBB2活性化変異
- S310F
- S310Y
- G660D
- R678Q
- D769Y
- D769H
- V777L
- Y772_A775dup または A775_G776insYVMA
- L755S
- G778_P780dup または P780_Y781insGSP
- T862A
- V842I
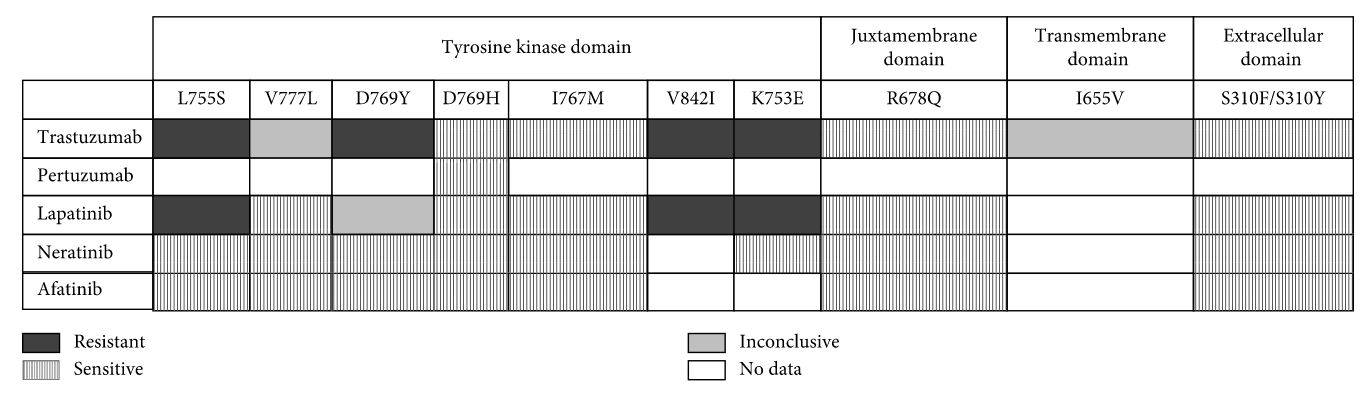
A775_G776insYVMAはERBB2 exon20 insertion mutationとしてもっとも高頻度に見られる活性化変異の1つであり*163、ピロチニブやパトリツマブデルクステカンなどの治療標的候補とも考えられている。
上記の他にも希少な活性化変異が多数存在することが知られている。たとえばERBB2 V659E*164*165などは治療標的となる活性化変異となる可能性がある。
どのようなERBB2活性化変異が見られるかは臓器毎に異なり、それに関するレビューが掲載されている*166。また一口にERBB2活性化変異と言っても、下図*167のように乳癌ではトラスツズマブやラパチニブなどに対して耐性を示すものもあれば感受性を示すものもあり、それぞれの違いに応じた治療を考慮する必要がある。
一般的に抗HER2療法は、抗EGFR療法と同じように、ERBB2下流のKRASやBRAFに活性化変異があると治療抵抗性となる(ERBB2を阻害しシグナルを遮断しても下流のRAS・RAFから勝手にシグナルが出るため)。しかし、T-DXd(トラスツズマブデルクステカン)などのADCはシグナル遮断ではなくドラッグデリバリーにHER2蛋白質を利用しているだけなので下流シグナルの活性化と関係なく治療効果を発揮することができ、KRASなどの活性化変異によっても治療効果が落ちにくいと考えられている。
その他のERBB2変異を標的とした治療
ラパチニブ・アファチニブ*168などのHER2-TKIの方が奏効の報告あり。ERBB2およびERBB3に対してネラチニブの投与を行ったSUMMIT試験がすでに報告されている*169が、ネラチニブは本邦未承認。
ERBB2変異非小細胞肺癌に対してピロチニブ(パイロチニブ pyrotinib)が有望視されている。サーモフィッシャー社のコンパニオン診断薬が開発されている*170。
ERBB2 exon20挿入変異
ERBB2とEGFRのexon20に挿入欠失変異などがある場合はこのEGFRとERBB2が病的ダイマーを形成し機能異常を来すため、これに対する特異的阻害剤ポジオチニブの有効性が報告されている*171。国内でも一部の臓器を対象とした治験が実施されている*172*173。2021/10
ERBB3(HER3)
ERBB3のG284R、V104M、R103Gなどの活性化変異ではアファチニブが候補と考えられた*174が、現在ではERBB3変異に対するアファチニブの有効性は否定的と考えられている。
ERBB3に対する抗体薬の臨床試験などが進められている*175。なお、パトリツマブデルクステカン(HER3-DXd)はHER3の発現レベルと有効性には相関がなく*176、HER3陽性だからと言ってHER3-DXdが推奨されるというわけではなさそうである。
ERBB4
現時点で標的治療なし。
ESR1
変異があれば内分泌療法(アナストロゾール、エキセメスタン、レトロゾール)の無効予測因子となりえる。これらの治療に耐性が生じた場合はフルベストラントが治療候補となる(あるいはタモキシフェンが使うこともある)。ただし、乳癌診療ガイドライン2018年版ではESR1を治療選択に利用するのは「臨床応用が期待される」と表記するにとどまる*177。
閉経後ホルモン感受性乳癌に対する長期のアロマターゼ阻害剤の治療後に高頻度に異常を生じる遺伝子である。この変異は第534〜538塩基に集中している。原発巣ではESR1変異はmajor cloneとして存在する頻度は3.3%以下と非常に稀である一方で、転移性乳癌に対するアロマターゼ阻害剤の治療歴がある患者では26.8%にESR1変異が見られたとの報告があることから、アロマターゼ阻害剤の治療歴によって原発巣にわずかに存在していたESR1変異陽性のsubcloneがclonal expansionする機序などが推測される*178。アミノ酸エストロゲン非依存的なER活性をもたらし、内分泌療法抵抗性を示す事が多い。
乳癌内分泌療法への耐性機序としてのESR1変異
内分泌療法耐性機序としてのESR1遺伝子変異
/日本内分泌甲状腺外科学会雑誌2019
https://www.jstage.jst.go.jp/article/jaesjsts/36/2/36_96/_article/-char/ja/
ESR1 Y537S、Y537N、D538G
エキセメスタン(アロマターゼ阻害剤)の耐性変異と考えられている。一方でSERD(フルベストラントなど)はESR1変異があっても比較的効果が保たれるため、乳癌ではフルベストラントを選択することを考慮しても良い(Y537Sなどの高活性型変異に対してはSERDも有効性が低いという報告もある*179)。
またmTOR阻害剤についてもエベロリムスについては次のような研究がある。転移性乳癌に関するBOLERO-2試験のcfDNA解析において、Y537SやD538Gを有する患者は生存期間が短いことが示されている(野生型32.1ヶ月、Y537S変異が19.98ヶ月、D538G変異が25.99ヶ月)*180。なお、この研究ではY537S変異は13.3%の患者に、D538G変異は21.1%の患者に見られたため、いずれも比較的頻度の高いESR1異常といえる。BOLERO-2試験は閉経後乳癌に対するエキセメスタンに対するエキセメスタン+エベロリムスの有効性安全性を検証した第3相試験*181。
EWSR1
EWSR1などのEWS関連遺伝子の融合遺伝子がユーイング肉腫などの小児〜AYA世代の肉腫で見られることがある。いくつかの治験が実施されているが、希少がんであり実用化された標的治療薬は今のところはない。
ユーイング肉腫ではカボザンチニブが有効との報告があるようだがEWSR1融合遺伝子の有無でセレクションした試験ではないのでがん遺伝子パネル検査に基づく推奨治療とはされにくいようである(もともとユーイング肉腫ではESWR1融合遺伝子が高頻度に見られる)。EWS-FLI1融合遺伝子陽性の肉腫などにトラベクテジンなどが使われることがある(成人では保険適用)。
EZH2
SMARKA4の欄を参照。
FANC family(FANCA、FANCC、FANCG、FANCL)
ファンコニ貧血関連遺伝子。FoundationOne CDxにはFANCA、FANCC、FANCG、FANCLが収載されている一方、NCCオンコパネルにはこれらは収載されていないことに注意する。
なお、FANCD1はBRCA2の別名で同じ遺伝子である(FANCD1=BRCA2)のでFANCD1についてはBRCA2の欄を参照。FANCD2はATMなどのHRR関連タンパク質と相互作用的にはたらく。FANCNはPALB2の別名で同じ遺伝子である。
FBXW7
推奨治療は無し。中皮腫や胆道癌や食道扁平上皮癌などで検出されることがしばしばある。またCCNE1増幅とFBXW7変異の同時出現は子宮癌肉腫などでしばしば認められる。この変異*182や欠損*183が見られる場合は予後不良とされる報告もある。
FGFR1/FGFR2/FGFR3
増幅も変異も起こり得るほか、染色体異常(fusionやrearrangement)もある。全固形腫瘍の7.1%に異常が見られるとの報告がある*184。この報告によると、66%が増幅で、26%が変異、8%が染色体構造異常(rearrangement)。FGFR1が3.5%、FGFR2が1.5%、FGFR3が2.0%。染色体構造異常については蛋白質へ翻訳されないものもパネル検査のレポートで報告されることに注意が必要。
FGFR1活性化変異
FGFR1変異に対する治療は現時点では確立されていない。
FGFR1 K656Eは活性化変異として知られており、FGFR阻害剤のインフィグラチニブの有効性が報告されている*185。一方でFGFR1 K656E(ホットスポット変異)とV561M(いわゆるGatekeeper変異)が併存する場合はFGFR阻害剤に対する耐性を生じる可能性が示唆される*186。
脳転移を伴うHR+HER2-乳癌に対するパゾパニブ投与が著効した症例報告がある*187。なお、パゾパニブは患者申出療養の対象となりえる。
FGFR阻害剤E7090や、スルファチニブなどの臨床試験も行われている。
FGFR2融合遺伝子
FGFR2 fusion/rearrangementを有する肝内胆管癌に対しては2020年4月にペミガチニブがFDAで承認され*188、本邦でもFGFR2融合遺伝子陽性に対して2021年3月にペミガチニブが承認となっている。
本邦のデータで肝内胆肝癌のうち5%程度がFGFR2融合遺伝子陽性となるが、これはRNAseqでのデータなのでDNA解析であるFoundationOne CDxの結果と乖離がある可能性があり*189、実際FoundationOne CDxでのFGFR2融合遺伝子の検出率はそれより低い可能性がある。
本邦では添付文書上はFGFR2融合(fusion)と書かれているが、遺伝子間領域の融合も対象とされているため再構成(rearrangement)も保険適用の範囲内ではないかと考えられる。FGFR2融合遺伝子陽性胆管癌に対するペミガチニブの試験のデータでは、intron17とexon18などのfusionとrearrangementでは同等の奏効率であったと記載されている*190。
ペミガチニブは当初はFGFR2/3変異なども対象に臨床試験を行っていたが、最終的にポジティブの結果が出て承認に至ったのはFGFR2のみであった。
FGFR2阻害剤フチバチニブ(TAS-120)の開発も進行中である。またAKT阻害剤TAS-117をフチバチニブ(TAS-120)と併用する試験も行われている(2021年8月)。現在FGFR阻害剤の保険適用がない臓器に対してもペミガチニブの患者申出療養の対象になる可能性もある。
エルダフィチニブのBLC2001試験の結果からFGFR2-BICC1とFGFR2-CASP7はエルダフィチニブ感受性であると報告されている*191*192。
FGFR2活性化変異
フチバチニブ、エルダフィチニブなどのFGFR阻害剤が有効である可能性があると考えられている。本邦ではFGFR阻害剤E7090の開発が進行中。胆道癌でFGFR2 Y375CやW290C等の活性化変異に対するペミガチニブの有効報告がある*193。
D101Y, S252W, P253R, A314D, A315T, S373C, Y376C, C383R, N550K, K660Eなどの変異のホットスポットがある*194が、これらに対する標的治療は確立されていない。
FGFR3活性化変異
FGFR3活性化変異のホットスポットとしてはR248C、S249C、G372C、Y375C、K652Eの5つがよく知られており、この5種類の変異でFGFR3活性化変異の90%を占める*195。浸潤性膀胱癌の10-20%ではこれらの変異が見られるとされている。
FGFR3活性化変異陽性の転移性膀胱癌に対してはFGFR阻害薬エルダフィチニブが奏効率40%を示し*196、2019年4月にFGFR3活性化変異陽性の転移性膀胱癌に対してFDAで承認された*197。BLC2001試験の結果からFGFR3の活性化変異でエルダフィチニブの有効性があると考えられエルダフィチニブの承認につながったのはR248C、S249C、G370C、Y373Cの4つである*198。
またFGFR3 Y373Cに対するペミガチニブの報告もある*199。フチバチニブ・ペミガチニブなどが開発進行中であり将来的に候補となり得る。
FGFR3 K650Eは活性化変異として知られており、FGFR阻害剤のインフィグラチニブの治療標的となり得るとの報告がある*200。
米国ではFGFR2/3変異をNGSベースの遺伝子パネル検査を行わずにPCRベースのコンパニオン診断薬で検査することができる*201。(2023/7)
FGFR3融合遺伝子
BLC2001試験の結果からFGFR3-TACC3とFGFR3-BAIAP2L1のFGFR3融合遺伝子はエルダフィチニブが有効とされてFDA承認につながっている*202*203。
泌尿器系以外でも、FGFR3-TACC3 fusion陽性の肺扁平上皮癌に対してエルダフィチニブが奏効したという一例報告がある*204。一方でペミガチニブのFIGHT-101試験ではFGFR3-TACC3 fusion症例が含まれていたが奏効しなかったようである*205。現時点ではFGFR3に対するFGFR阻害剤の有効性は確立はされていない。ペミガチニブの患者申出療養の対象になる可能性がある。
FGFR1増幅・FGFR2増幅
FGFR1増幅はパゾパニブが有効との報告もある*206。ただしFGFRは小児がんなどで強いドライバー変異となるものがあるものの、成人では多くの場合はFGFR familyの異常がドライバー変異とは言えないケースが少なくないために、真に治療標的になり得るものかどうかは慎重な検討が望ましい。もともとFGFR1増幅はユーイング肉腫などの肉腫で高頻度に見られる遺伝子異常であるため、FGFR1増幅がパゾパニブ奏効予測因子なのか単純に肉腫に対して効いているだけなのかの判断が難しい。FoundationOne CDxでは、FGFR1増幅などがある場合でも臓器によってパゾパニブなどが推奨薬に載ったり載らなかったりするようである(胆膵癌や乳癌では推奨され、婦人科癌などでは推奨されない?)。今後のエビデンスの蓄積により推奨が変わる可能性がある。パゾパニブは患者申出療養の提供薬剤に含まれているがFGFR1の増幅に患者申出療養を認めるかどうかはそれを実施する中核拠点病院の判断による。
高度にFGFR2増幅の胃癌などに対してパゾパニブが長期奏効した症例報告がある*207*208が、奏効が見られるのはcopy数は16以上と高値である。
その他のFGFR family
FGFR1-3阻害剤のフチバチニブ(TAS-120)やほかにいくつかのFGFR阻害剤が候補*209となる。レンバチニブがFGFR経路を含むマルチキナーゼ阻害剤であり、このために推奨薬の候補に上がってくることがあるが、現状ではFGFR family変異に対するレンバチニブのエビデンスは乏しい。
エーザイの新規FGFR阻害剤E7090の臨床試験が国内各所で行われていた*210が増幅例については募集終了している可能性あり。
頭頸部癌でFGF3, FGF4, FGF6, FGF19, FGF23の増幅を示した症例でpan-FGFR阻害剤がCRを示したという症例報告がある*211。
臓器によってはフチバチニブ(TAS-120、FGFR阻害剤)+TAS-117(AKT阻害剤)の臨床試験などが進行中である。
FLT3
FLT3は未熟な造血細胞に発現する受容体チロシンキナーゼで、免疫細胞の浸潤(特にNK細胞と樹状細胞)、T細胞疲弊マーカーの発現増加、cGAS-STING経路のエフェクター遺伝子の発現増加と関連しており、その結果、免疫療法や放射線療法に対する感受性が高まる可能性がある。肺腺癌・肺扁平上皮癌の報告で、FLT3が高発現の場合は免疫チェックポイント阻害剤や放射線療法の感受性を増加させてDFSなどを改善させることが示唆されている*212。
FLT3増幅陽性大腸癌に対してFLT3阻害作用を持つスニチニブの有用性を検証した小規模な報告では、10症例にスニチニブを投与して有効症例は1例も見られなかった*213。このため、FLT3増幅腫瘍に対してFLT3阻害剤を投与しても抗腫瘍効果は得られない可能性がある。FLT3増幅大腸癌に対するレゴラフェニブなどの有効性が検討されたことはある*214ものの、FLT3と関係なく大腸癌そのものに対してレゴラフェニブが標準治療として確立されているので、大腸癌以外のFLT3増幅腫瘍に対してレゴラフェニブを推奨する根拠は乏しい。血液腫瘍では、FLT3/ITD陽性急性骨髄性白血病に対してソラフェニブが有用である可能性が報告されている*215。ギルテリチニブなどが候補となる可能性が言われていたこともあるが、現状では固形癌に対してギルテリチニブが推奨されることはあまりない。
GNAQ
MEK阻害剤(セルメチニブ・トラメチニブ)が推奨されることがあるが、現時点では極めてエビデンスが乏しいようである。悪性黒色腫に対するセルメチニブ単剤の第2相*216、セルメチニブ+ダカルバジンの第3相*217のサブ解析ではわずかにGNAQ Q209変異陽性群で効果が高い傾向ではあるようである。なおトラメチニブは患者申出療養の対象となる可能性がある。
HGF
HGF増幅などが報告されることがあるが、現時点では有効な治療候補はない。
HRAS
頭頸部扁平上皮癌ではHRAS変異に対してVAFが20%以上のコホートでティピファルニブが奏効率55%、PFS 5.6ヶ月(対照群3.6ヶ月)という成績を示している*218。
HRAS Q61変異にMEK阻害剤が候補とされる可能性はたびたび言及されるが、文献化された報告がないため有効とするにはエビデンスが足りないと考える。(2022/4)
IDH1/IDH2
グリオーマや軟骨肉腫ではIDH1の変異が、急性骨髄性白血病や血管免疫芽球性T細胞リンパ腫においてはIDH2遺伝子の変異が、多く報告されている。神経膠腫においてはIDH変異および1p/19q co-deletionの有無がWHO分類上も必要な因子となっていて、分子診断が行われない場合はNOSとして確定診断ができない*219。
血液腫瘍ではダサチニブなどの治療開発が進行中。
IDH1変異脳腫瘍
Diffuse astrocytoma、Glioblastoma、Oligodendrogliomaは2016年から分子マーカー(IDH変異および1p/19q共欠失)の有無がWHO診断基準に含まれている。IDH1変異を有する症例では予後が良好とされているが、現時点で標的治療はない*220。
IDH1変異胆管癌
第3相ClarIDHy試験でIDH1変異胆管癌の二次治療におけるイボシデニブ(ivosidenib、AG-120)の有用性が、プラセボ群に比べて優位にPFSを延長したことが報告され*221、副次的評価項目のOSではクロスオーバーの多さにより有意差が付かなかったがクロスオーバーを除外補正するとOS 5.1→10.3ヶ月の延長を示した*222。米国ではこのイボシデニブが承認されているが国内では未承認(2021/10)。
IDH1変異AML
IDH1変異陽性の急性骨髄性白血病では標準治療とイボシデニブの併用によりイベントフリー生存期間およびOSの延長が示されており*223、FDAではイボシデニブがすでに承認されている*224。
IGF1, IGF1R, その他IGF family
胃癌や肝癌などで見られ、予後不良因子と考えられている。現時点で治療薬の候補は乏しい。
JAK1/JAK2/JAK3
JAK1は固形がんでは子宮体癌・乳癌・大腸癌・前立腺癌などで変異が報告されており、その変異頻度は全がんの1.78%とされる*225が、これはMSI-H固形がんでJAK1 frameshiftが高頻度に見られることに関連しており、子宮体癌や大腸癌でもMSSの場合はJAK1変異の頻度はそれほど高くはない*226。また同じ報告の中でTMBが高い癌でJAK1変異が多く見られることも報告されている。JAK1/JAK2変異を有する固形がんはPD-L1やINFγの発現が欠損して抗PD-1療法に耐性を有することが報告されている*227。JAK2/JAK3の変異はJAK1に比べて極めてまれ。
2020年9月時点では実用化された標的治療は存在しない。JAK1/JAK2阻害剤ルキソリチニブの有用性は造血器腫瘍(骨髄線維症、真性多血症)では認められている*228が、固形がんでは有効性の報告は乏しい。
JAK1阻害剤フィルゴルチニブは関節リウマチ等に対してFDAに承認申請が出されていたが、2020年9月時点では精液への悪影響の懸念などから承認が保留となっている*229。
KDR
KDR増幅を認める固形がんには抗血管新生阻害剤が有用である可能性が示唆されたことはあるが現時点では推奨できるだけの根拠は乏しい。
KEAP1
KRAS変異陽性非小細胞肺癌ではKEAP1は免疫チェックポイント阻害剤に対する耐性を生むと考えられているが、KRAS野生型非小細胞肺癌ではこの傾向は見られないと報告されている*230。KEAP1・STK11・KRAS・TP53などの複数変異を持つ場合は免疫チェックポイント阻害剤(アテゾリズマブ)治療効果が乏しいことが報告されている*231。
KIT
KIT変異ではイマチニブ・ボスチニブ・ニロチニブ・ダサチニブなどが候補となる可能性あり、特に変異塩基によってはニロチニブで悪性黒色腫での有効性報告がある*232。この報告では増幅例も変異例も含まれているが増幅は15例中1例しか奏効がなく、変異は17例中5例の奏効例が見られていることを考えると、KIT増幅例に対するニロチニブは推奨しにくくKIT増幅はむしろイマチニブなどの耐性変異である可能性があり、GIST*233やメラノーマ*234でイマチニブ耐性変異に関する報告などが多数ある。
またレゴラフェニブが候補となることもある。
なおPDGFRαの異常を合併している場合にイマチニブが候補として検討されることがあり、PDGFRの項を参照。
パゾパニブ、ソラフェニブ、ポナチニブ、ニロチニブ、ダサチニブなどが候補に上がることがある。特にパゾパニブなどは患者申出療養の対象薬になる。(2022/4)
KRAS
下記に挙げた限られた塩基の変異以外にはほとんど治療効果がある選択肢は無い。一方で大腸癌などで標準治療となっているEGFR抗体はKRAS変異があると耐性となる。エルロチニブなどのEGFR-TKIもKRAS変異が陽性であると耐性がしばしば見られるなど様々な耐性にも関与している遺伝子である。C-CAT調査報告でトラメチニブが推奨されることがあるが(学会報告レベル?)、積極的に有効と考える根拠は乏しい。

KRAS G12C
G12Cなど一部のKRAS変異は特異的治療薬の開発が進んでおり、ソトラシブ(AMG510)が2021年5月にFDA承認された。国内でも非小細胞肺癌で承認されたが2022/2時点では薬価収載されていないため使用できない(近日使用できるようになる見込み)。
KRAS G12C大腸癌に対するソトラシブはJSMO2021でCodeBreaK100試験の大腸コホートの結果が発表されたが、ORR 12.0%でPFS 4ヶ月と大腸癌ではあまりかんばしい結果では無かったため単剤での承認の見込みは乏しい。他剤との併用療法で開発が継続される可能性はある。またソトラシブ不応性のKRAS G12C固形がんに対するソトラシブ+αの併用療法のCodeBreaK101試験が進行中で国内でも募集がされているが、1つの臨床試験のようでありながら臓器別に募集および開発が行われているので、臓器により参加可否や試験結果解釈が変わる可能性あり。
ソトラシブにかわるKRAS G12C阻害剤としてアダグラシブ(MRTX849)の開発が進んでおり、2021年6月にFDAのbreakthrough therapyに指定されている*235。アダグラシブは第1/2相KRISTAL-1試験において消化器癌に対しても高い奏効率を示すという中間結果が発表*236されているが、現在進行中であり最終結果の発表が待たれる。
グレシラシブ(JAB-21822)の開発も進んでおり臓器横断的に行われた中国と欧米の2つの第1/2相のプール解析がASCO GI2024で発表され、ORR 46.4%、DCR 96.4%と良好な結果であったが、DORは4.1ヶ月と短く長期間の作用持続には課題が残る*237。
KRAS G12D
膵癌(36%)や大腸癌のKRAS変異ではG12D変異の頻度が高い。肺癌はKRAS変異のうち15%程度を占める。
KRAS G12D変異に対してはMRTX1133の治療開発が進んでいる*238。またKRAS G12Dに対するT細胞受容体改変T細胞を用いた細胞療法(TCR-T療法)がASCO2022およびNEJMに報告されている*239*240。
KRAS G12V
トラメチニブで有効例の報告あり?。
AACR2021でバスケット型第1相FRAME試験の結果からRAF-MEK阻害薬VS-6766とFAK阻害薬デファクチニブの併用が有効な可能性が報告*241され、今後が期待される。
KRAS Q61H
KRAS Q61Hを有する頭頸部癌にMEK阻害剤トラメチニブが有効であるという報告は症例報告レベル*242では存在する(すなわちエビデンスレベルD)。ただし、確立された治療とまでは言えない。(2022.4)
小児癌に対する個別化医療の有効性を検証したpediatric MATCH試験*243のarmE(セルメチニブ群)で21例中1例だけKRAS Q61Hの症例が含まれており48週間SDで推移し有効であったと報告されている*244が、このarmEでは奏効例が1例もなかったためMAPキナーゼ経路の異常に対するセルメチニブ単剤療法の有効性は限定的であると報告されている。
KRAS/NRAS WT
大腸癌においてはRAS野生型は抗EGFR抗体の奏効予測因子となる。ただしRASKET-Bなどの従来型コンパニオン検査ですでにKRAS/NRASの変異が見つかっている症例の遺伝子パネル検査でRAS野生型との結果が得られた場合はいわゆるneoRAS(RAS reversion変異)と呼ばれる変異となる。
遠隔転移と原発巣など異なる病変からのサンプルを検査に提出した場合にはしばしばこのような乖離がみられる*245が、同一検体からRASKETと遺伝子パネル検査を提出した場合にもこのような変異が見られることがあり、これは腫瘍内heterogeneityやカットオフ値の差に由来すると考えられている。抗EGFR抗体の使用自体は可能と思われるが、いわゆるneoRASは通常のRAS野生型と比べて抗EGFR抗体の奏効率が低いとの報告がある。また大腸癌の場合はリキッドバイオプシー(OncoBEAM)でのRAS再検が保険診療で行えるためこれによるRAS変異の再検を考慮する。
RAS変異の不一致に関しては興味深い報告が多数ある*246。
LKB1
STK11の別名。STK11の欄を参照。
MAP2K1(MEK1)
MEK阻害剤が推奨されることがあるが高いレベルの有効性報告がなく、推奨して良いのかどうか判断が難しいところ。基礎研究レベルではMEK阻害剤の有効性を示唆するデータが複数ある*247*248。NRR欠損型inframe-deletionに対してMEK阻害剤セルメチニブが著効したとの報告*249があり、機能変異を示すinsertion/deletionの場合はMEK阻害剤を考慮する。
MEK阻害剤への耐性変異としてMAP2K1(MEK1) V211D変異が報告されている*250。古い報告ながら他のMAP2K1(MEK1)変異でもMEK阻害剤・BRAF阻害剤への体制を示唆する報告がある*251。
MEK阻害剤トラメチニブの患者申出療養(NCCH1901受け皿試験)の対象となる可能性がある。
MDM2
p53パスウェイにあってMDM2の過剰発現がp53機能の不活化に関与する*252。MDM2がコードするMdm2タンパク質は別名E3ユビキチンリガーゼとも呼ばれる。予後不良因子とされているが、確立されつつある治療薬の候補は乏しい。
MDM2増幅
軟部肉腫などでは高頻度に増幅が見られるが現状では確立された治療は無い。またMDM2阻害剤はTP53野生型のみを対象にして治療開発されているものが多い(つまりMDM2増幅があってもTP53変異がある場合は治療の対象外となる)。たとえば、MDM2増幅かつTP53野生型の切除不能胆道癌に対するMDM2阻害剤BI 907828の有効性を評価する第2相Brightline-2試験*253などが国内で行われている例である。
いくつか治験候補ある。そのうちの1つは2019年2月から国立がん研究センターでMASTER KEY projectの5つ目の医師主導治験として実施されていた内膜肉腫に対するMDM2阻害剤ミラデメタン(DS-3032b)の臨床試験。希少がんの1つである内膜肉腫は心臓や肺動脈付近に生じる予後不良の悪性腫瘍で約60-70%にMDM2増幅を伴う。
https://www.ncc.go.jp/jp/information/pr_release/2019/0204/index.html
肉腫を対象にアンブレラ試験として実施されたSAMBA101試験では、特に脂肪肉腫でMDM2増幅群が多数見られ、MDM2阻害剤による2年以上の奏効が複数例見られたとされている*254。
MDM2 rearrangement
脂肪肉腫など軟部肉腫でしばしば見られる。有望な標的治療は無し。
MEK1
MAP2K1と同義なのでMAP2K1の欄を参照。
MET
METの異常は「MET増幅」と「METエクソン14スキッピング変異」を明確に区別して考える必要がある。特に後者はコンパニオン診断に基づく標的治療が実用化されている。
MET依存性腫瘍に関するレビュー(2020.6)
https://pubmed.ncbi.nlm.nih.gov/32514147/
METエクソン14スキッピング変異(METΔex14)
METエクソン14スキッピング変異は検査法により感度の乖離があることが知られており、特にオンコマインとテポチニブのコンパニオン診断検査であるArcherMETでは最大30%の結果の乖離があることが知られている*255。オンコマインのテポチニブに対するコンパニオン診断機能の承認申請が出されているが、2021年7月時点ではオンコマインはその承認をまだ得ていない。
クリゾチニブ
METΔex14変異を有する非小細胞肺癌に対するクリゾチニブの有用性が報告されている*256。第2相試験が進行中*257。
Y1230C(耐性変異)
METΔex14の非小細胞肺癌に対するクリゾチニブの耐性を生じる変異としてMET Y1230Cの報告がある*258。
MET阻害剤(テポチニブ、カプマチニブ)
METΔex14変異を有する非小細胞肺癌に対しては、日本ではテポチニブ、米国ではカプマチニブが承認されている*259。
カプマチニブ
米国で承認されたカプマチニブは脳転移を有するMETエクソン14スキッピング変異陽性非小細胞肺癌に対してはGEOMETRY mono-1試験(第2相)で有効性が示唆されている*260。2020年7月からカプマチニブも本邦でMETエクソン14スキッピング変異陽性非小細胞肺癌に対して承認された*261。
カプマチニブ投与前のMETΔex14変異の判定のためのコンパニオン診断薬はFDAおよび日本で共にFoundationOne CDxが承認されている*262。
なお、テポチニブもカプマチニブもMET阻害剤のエビデンスは「EGFR変異陰性かつALK融合遺伝子陰性」の非小細胞肺癌に限って行われた試験に基づいている。「EGFR変異陽性」の場合はMET変異が陽性でもMET阻害剤の有効性が期待できるとは言えない。この場合はEGFR変異陽性腫瘍に基づいて治療を行うことが標準治療と考えられるが、MET増幅はEGFR-TKIによる治療を実施した後に出現するEGFR-TKIに対する耐性変異として知られている*263。
テポチニブ(テプミトコ)
日本で承認されたテポチニブはVISION試験(第2相)で奏効率42.4%、走行期間中央値12.4ヶ月で、肺癌に対して世界で最初に承認されたMET阻害剤である*264。
なお、非小細胞肺癌に使用する場合もArcher社のコンパニオン診断システムで検出したMETΔex14変異であることが必要である。
MET増幅
カプマチニブはコピー数10以上のMET増幅に対して一定の有効性を示すデータがある*265*266ため、FoudantionOne CDxのレポートではMET増幅に対してカプマチニブが推奨される。しかしMET増幅は本邦では保険適用外である(2021年1月時点でカプマチニブの保険適用はエクソン14スキッピング変異のみ)。
なお、Ann Oncolに掲載されたMET増幅に対するカプマチニブのデータでは、MET増幅はDNAベースNGSでの増幅(コピー数5倍以上)だけでなく、病理組織学的な評価でのIHC 2+/3+やMET/centromere比>2なども含めていることに注意。またこのカプマチニブのAnn Oncolに掲載された第1相試験はEGFR変異症例は原則として除外されており、MET増幅自体がEGFR-TKIの耐性変異であるため、EGFR変異とMET増幅のco-mutation/co-alterationはEGFR-TKIもMET阻害剤もいずれも推奨されない。これらのMET増幅は、オシメルチニブなどに対する耐性変異であると考えられる*267*268。
METエクソン14スキッピング変異陰性かつMET増幅があるEGFR変異陰性の非小細胞肺癌についてはクリゾチニブの有効性に関する報告*269*270があり、これもFoundationOne CDxのレポートでも推奨となる。なお、増幅はFISHでバックグランドに対して5倍以上(つまりベースラインを2とするとコピー数10以上)で増幅陽性と判定されている。クリゾチニブについては現在MET増幅およびMETΔex14の非小細胞肺癌に対する第2相試験が進行中*271。クリゾチニブの場合は患者申出療養制度(NCCH1901受け皿試験)の対象となる可能性がある。
MET増幅進行大腸癌に対してカボザンチニブ単剤またはカボザンチニブ+パニツムマブ併用の比較第2相試験が行われている*272。本研究はBRAF V600が野生型であることが条件となる(BRAF V600E変異を要する大腸癌の場合はそちらに準じて標準治療を行うか、BRAF阻害剤+MEK阻害剤(±EGFR抗体)を選択する。
他にテリソツズマブなどの臨床試験が進行中。
MET変異
MET変異は基本的に推奨治療がないことが多いが、C-CAT報告書などで臨床試験が提示されることはある。
MET Y1003N
MET Y1003変異はクリゾチニブが奏効するという報告が散見される*273*274。このほかに下記のようにMETの活性化に関わるCNVやindelなどの変異が報告されている*275。
exon14の変異であることからMETΔex14に似た活性化を示す可能性がある。ただしこれらの変異はコンパニオン診断外であると考えられるため、これに基づく治療は適応外使用となることに注意が必要。
MEN1
MLH1、MSH2、MSH6、PMS2(ミスマッチ修復遺伝子)
ミスマッチ修復遺伝子の代表的な4遺伝子*276。多くは1塩基置換だが、まれながらMLH1とMSH2には大きな領域の重複や欠失が見られることがある*277*278*279。
FoundationOne CDxでMSH6しばしば1358〜1360番目塩基のframeshiftが病的変異とレポートされることがあるが、もともとMSH6は1360塩基の遺伝子であり末尾のコドンのframeshiftは日本人にしばしば見られる多型と考えられる*280。
検査方法の違いによる不一致
MSI検査やパネル検査を用いなくても組織標本の免疫染色でもdMMRの判断が可能であり、dMMRとMSIの一致率は非常に高いと考えられている。しかし中にはdMMRとMSIの不一致が見られる事例があるので注意を要する。
腫瘍細胞率が低い場合
腫瘍細胞率が低いと(PCRベースの)MSI検査の感度は低下することが知られている。したがってMSI検査でMSI-LやMSSと判定されていてもdMMRのケースが発生しやすくなる。
MSSとMSH6
(PCRベースの)MSI検査でMSSと判定がなされてもMSH6については異常を有することはあるので、濃厚な家族歴があるなど臨床的にリンチ症候群を疑う場合はMSSと判定されていても組織標本でMSH6の免疫化学染色を検討することを検討して良い。
放射線治療後やプラチナ製剤化学療法後
DNA損傷を多数引き起こすような治療の修飾によりMSH6蛋白質やMSH1蛋白質の発現が消失することが知られている。この場合は免疫染色でdMMRがpMMRと判定される可能性がある。
リンチ症候群と大腸癌のBRAF変異変異
大腸癌において、MSI-HまたはMLH1発現消失を認めた場合であってもsomaticなBRAF V600E変異が陽性であればリンチ症候群はほぼ否定できる*281*282ため遺伝性腫瘍確定診断検査に進む必要性はかなり低い。つまりMLH1変異の場合は「BRAF変異陽性ならリンチ症候群は否定的」はほぼ確実に成り立つ。一方でPMS2発現消失を認めるリンチ症候群の場合はBRAF V600E変異が合併する事があり*283、必ずしも「BRAF変異陽性だからリンチ症候群は否定的」とは成り立たないため、注意が必要である。
候補薬剤
免疫チェックポイント阻害剤
ミスマッチ修復遺伝子機能欠損がある場合はdMMRであることから免疫チェックポイント阻害薬が強力な治療候補として検討されるが、保険診療としてペムブロリズマブを使用する場合はコンパニオン診断薬(MSI検査)での確定診断が必要となる。ただし、コンパニオン診断のグループ化について検討されており、ほぼ同等の検査手法で判定された遺伝子検査結果は援用できるようにすることが議論されており、近日中に遺伝子パネル検査でMSIと判定された場合にはコンパニオン診断薬(MSI検査)での判定がなくてもペムブロリズマブの使用が可能となる公算が大である。
ペムブロリズマブはMSI-H固形がんに対して臓器横断的に承認されているが、ニボルマブおよびイピリムマブはMSI-Hでも固形がん全般ではなくMSI-H大腸癌に限って承認されていることに注意(2021年3月時点)。
フッカピリミジン系薬剤耐性
大腸癌での検討からMSIおよびdMMRでは5-FUやフッカピリミジン系薬剤の耐性が高頻度に見られることが知られている。また切除可能腫瘍である場合は転移再発などをきたす頻度が相対的に低い。このために術後化学療法による予後改善効果が得られにくく、リンチ症候群やMSI-Hの大腸癌では切除後の術後化学療法の必要性が散発性大腸癌に比べて相対的に低下することがメタ解析で示されている*284*285。
臨床的にハイリスク群であることから術後化学療法を行う場合は、stageIIIに関してはNSABP-C07試験やMOSAIC試験での追加検討の結果からプラチナ系の併用が推奨される*286(つまりカペシタビン単独療法ではなくCAPOX療法を検討する)。stageIIでは術後化学療法は推奨されない。(遺伝性大腸癌診療ガイドライン2016年版)
イリノテカン
小規模ながら、散発性MSI-H大腸癌ではイリノテカンの奏効率が高いとの報告がある*287が、一般に散発性MSI-H大腸癌自体がMSS大腸癌より予後良好であることから、この研究のみでイリノテカンを推奨することがコンセンサスを得ているとは言えない。
アスピリン(予防的投与)
CAPP2試験*288でリンチ症候群における長期アスピリン療法が大腸癌および大腸癌以外のリンチ症候群関連腫瘍を抑制したということが報告されたが、これはアスピリンを大量(600mg/day)に投与した試験なので日本人集団には外挿しがたい。その他に後方視的研究がいくつかなされている。低用量アスピリンがリンチ症候群において発癌を抑制するかどうかは現在臨床試験が進行中。
遺伝性腫瘍(リンチ症候群、家族性非ポリポーシス大腸癌:HNPCC)
生殖細胞系列にミスマッチ修復遺伝子(MLH1、MSH2、MSH6、PMS2)のいずれかの異常を生じた場合はリンチ症候群の原因遺伝子として非常に重要である。特にMLH1とMSH2は浸透率が高い。この4つのほかにEPCAMやMSH3もリンチ症候群の原因となり得る。変異の頻度はMLH1(32%)、MSH2(39%)、MSH6(14%)、PMS2(15%)と報告されている*289。ただしリンチ症候群の場合はMSI-Hとなることが多いため、事前にMSSであることが判明している場合はリンチ症候群の事前確率は低いと考えられる(リンチ症候群でもMSS腫瘍ができることはあるためMSS腫瘍であることだけを根拠にリンチ症候群の可能性を除外することはできないことに注意が必要)。
開示推奨度は最上級のAAA、T-only panelでのgermline testの必要性も◎であり、積極的に遺伝カウンセリングを考慮する。特に消化管癌、子宮体癌、卵巣癌などでは高頻度である。ほかに胆道癌・膵癌・腎癌・尿管癌・脳腫瘍・皮膚腫瘍などの関連が示唆される。遺伝性大腸癌診療ガイドラインでは、消化管癌と婦人科癌の他に腎盂・尿管癌の1-2年毎のサーベイランスを提案しているが、そのサーベイランスに関してどの方法(尿定性?細胞診?)などは定まったコンセンサスはない。
リンチ症候群を疑う場合はMMR遺伝子の生殖細胞系列変異の確定検査を行うが保険適用外となる(ただし検査実施できる施設には条件がありどの医療機関でも実施できるわけではない)。
ミスマッチ修復遺伝子異常ではリンチ症候群が非常に注意を向けられがちだが、他にターコット症候群(MLH1、PMS2遺伝子異常)やムア・トレ症候群(MSH2遺伝子異常)もある。特にターコット症候群は大腸癌だけでなく脳腫瘍・神経膠芽腫を合併することがある。
原因遺伝子の違い
リンチ症候群における大腸癌の発生リスクはMLH1とMSH2はほぼ同等であるが、大腸以外ではMSH2で尿路上皮癌など大腸癌以外のリスクが高いとされている*290。
MSH6変異例では大腸癌のリスクがMLH1やMSH2より低いが子宮体癌のリスクはMSH6のほうが高い。
PMS2変異例は発癌リスクはやや低いとする考察もあるが、そもそも発見される頻度がやや少なくデータが乏しい。なお、PMS2変異例ではBRAF変異陽性でもリンチ症候群を否定できないことに注意(後述)。
リンチ症候群関連腫瘍の原因遺伝子別の70歳までの発癌頻度*291。これは米国のデータであることから日本人集団に比べて胃癌などの発生頻度が大きく異なることに注意が必要。
| MLH1 | MSH2 | MSH6 | PMS2 | 一般集団 | |
| 大腸癌 | 41% | 48% | 10-22% | 15-20% | 5.50% |
| 子宮体癌 | 18-54% | 21-30% | 16-71% | 15% | 2.70% |
| 胃癌 | 3-6% | 0.2-7% | 3%以下 | 1%以下 | |
| 卵巣癌 | 13-20% | 9.5-24% | 1-11% | 1.60% | |
| 腎盂尿管癌 | 0.2-2.9% | 2.2-12% | 1%未満 | 1%未満 |
MLL2
小児白血病やBurkittリンパ腫のような高悪性度(aggressive)の造血器腫瘍に関与する。現時点で確立された標的治療なし。
ERBB2-TKI耐性
HER2陽性腫瘍細胞で増殖にMLL2が関与しているとの話があり、ラパチニブ耐性に関与するとの報告がある*292。
MTAP
MTAP lossに対してMTAP阻害剤の早期治験が開始されつつあるが有効性に関してはまだ未確立。
mTOR
mTORを含みmTORパスウェイに遺伝子変異がある場合は免疫チェックポイント阻害剤の有効性が高いと期待されるとの報告がある*293。
MUTYH(MYH)
遺伝性大腸癌の原因となる遺伝子だが、常染色体潜性(劣性)遺伝の遺伝形式をとる(遺伝性腫瘍の中では常染色体潜性遺伝の遺伝様式を取るものは極めて稀である)ため、両親の両方からホモ変異になるように病的アリルを譲り受ける必要があり、実際に遺伝性腫瘍として発見されることは極めて稀である。ヘテロの場合は発癌の原因とならないと考えられている(したがってヘテロの場合は二次的所見として扱わないことが多い)。
両アレル変異がある場合の大腸癌リスクに関する報告*294では、KRAS G12CやPIK3CA Q546K変異と共存することで発癌リスクが増加するとされている。別の報告でも、生殖細胞系列で両アレルにMUTYHの変異があると大腸癌が増えることを示唆するデータベース研究があり、*295TMB-highや塩基除去修復異常型(SBS18)のシグニチャを示すとされる。本研究で生殖細胞系列の片アレル変異でもLOHにより癌と関連する可能性は示唆されるものの、データベースでの報告数からの推計なのでこれが発癌を増やすかどうかは定かでない。
MUTYH splicesite variantは東アジア人では頻繁に見られ、日本人の4%が片アレル変異を持つ。ポリポーシスの有病率はこれよりずっと低いため、splicesite variantの場合は病的意義がないものが極めて多いと推測される。
MYB-NF1B fusion
腺様嚢胞癌に高頻度に見られ(50〜80%)、とくに唾液腺癌などの頭頚部癌に特徴的。予後不良因子、特異的治療は無し。
MYC
現時点で推奨治療なし。
2023年初頭からMYC阻害剤の有効性に関する初期の報告が出てきており*296、今後の治療開発の進展が期待される。
NF1/NF2
NF1の変異についてはGlioblastomaや一部の脳腫瘍*297および悪性黒色腫*298ではトラメチニブ・コビメチニブ・セルメチニブ(※本邦未承認)などのMEK阻害剤が有効との報告がある(患者申出療養の対象でもある)。ただしこれまで有効であった症例報告は生殖細胞系列にNF1変異を持つ神経線維腫症1型(von Recklinghausen病)の症例に限られていることからMEK阻害剤などの推奨も生殖細胞系列に変異を認める症例のみに推奨すべきと考えられ、体細胞変異のみのNF1変異を検出したほかの臓器では推奨されないと考える。von Recklinghausen病は神経線維腫、カフェオレ斑などの皮膚病変のほかに眼・神経系・副腎・消化管などに多彩な病変を示す常染色体優生遺伝性疾患である。(2020.9)
神経線維腫症1型(レックリングハウゼン病)に関連する腫瘍の場合は二次的所見の可能性を考慮する。脳脊髄腫瘍(視神経膠腫・毛様細胞性星細胞腫・脊髄腫瘍など)、消化管間質腫瘍(GIST)、褐色細胞腫、悪性末梢神経鞘腫瘍などがこれに含まれる。
NF2に伴う遺伝性疾患としては多発性髄膜腫や前庭神経鞘腫を来す神経線維腫症2型があるが、極めてまれ。どちらかというとめまい・平衡機能障害など前庭神経機能に異常を来す疾患として知られている。歴史的にはNF1異常(レックリングハウゼン病)の部分症と考えられていた時期が長かった。
NFE2L2(NRF2)
NFE2L2は別名NRF2でKEAP1とシグナル形成しており、恒常的活性化変異は種々の薬剤耐性や放射線照射耐性を示す*299。頭頸部癌・食道癌などの扁平上皮癌で活性化変異がしばしば見られる(喫煙との関連が示唆されている)。
NFE2L2活性化変異を示す肺扁平上皮癌に対してTORC1/2阻害剤サパニセルチブ(TAK-228)がORR 25%、PFS 8.9ヶ月の効果を示したとの報告*300があるが、サパニセルチブは現時点では本邦では入手不能である。2023年から本邦でも第2相試験が実施される見込みである。(2022/11追記)
NOTCH1
現時点では推奨治療は無し。
NRAS
NRAS G12C
3つの主要なRASアイソフォームであるKRAS、NRAS、HRASのアミノ酸配列は非常に類似していることから、KRASG12C阻害剤の中には、NRASG12CやHRASG12Cも標的とするものがあるのではないかと考えられており、実際にKRAS G12C阻害剤とEGFR抗体の併用が有効である可能性を示唆する報告*301*302がある。
そのほかにNRAS G12やG13変異に対してMEK阻害剤ツンラメチニブなども開発進行中で第2相で奏効率35.8%と報告された*303。
NRAS Q61
ダカルバジンとビニメチニブを比較した悪性黒色腫での報告*304から、Q61K・Q61L・Q61RのいずれかにはMEK阻害剤(トラメチニブ、ビニメチニブなど)が治療候補となることがある。ビニメチニブに比べるとトラメチニブの単剤のエビデンスは乏しいが、ビニメチニブはBRAF V600E変異に対するエンコラフェニブとの併用に限り患者申出療養の対象薬となるため、NRAS Q61に対してビニメチニブ単剤を患者申出療養制度で使用することは難しく、その場合はトラメチニブを検討する(2021年10月現在)。エビデンスが頑健とは言いがたく、NRAS Q61変異に対してMEK阻害剤を推奨するかどうかは各中核拠点病院のエキスパートパネルによって判断が分かれる可能性がある。
そのほかにNRAS Q61変異に対してMEK阻害剤ツンラメチニブなども開発進行中で第2相で奏効率35.8%と報告された*305。
セルメチニブが治療候補として上がってくることがあるがセルメチニブは抗腫瘍薬としての容量設定がされているとは限らないこと(小児のNF1神経線維腫症の治療薬としての設計・治療開発をされている)、またKRASなどを対象としたセルメチニブの臨床試験の多くがネガティブに終わり開発が滞りつつあるに注意が必要。
NRAS変異悪性黒色腫に関するレビュー
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4830486/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5689549/
NRAS変異自体は悪性黒色腫で予後不良因子の1つと考えられている。
NRG1
NRG1 fusionは膵癌・胆嚢癌・腎癌などの0.5%程度に見られ*306、KRAS変異陰性の膵癌などでは治療標的候補の1つと考えられている*307。統合失調症の発症にも関与している。2023年7月にNRG1 fusion陽性非小細胞肺癌に対して第1/2相eNRGy試験で奏効率34%を示したゼノクツズマブがFDA breakthroughに指定された*308。
なお、2023/7月時点ではNRG1はFoundationOne CDxの解析対象遺伝子には含まれていないが、NCCオンコパネルの解析対象遺伝子には含まれている。
NTRK(NTRK1、NTRK2、NTRK3)
NTRK1、NTRK2、NTRK3はそれぞれTRKA、TRKB、TRKCと呼ばれることもある。
成人では全癌腫で1%程度が該当するとされているが、小児癌では検出頻度が高い。エヌトレクチニブの良い適応となる。ラロトレクチニブ(本邦未承認)も有用で本邦でもエヌトレクチニブに続いてラロトレクチニブが承認されている。
急性骨髄性白血病に対するギルテリチニブもNTRK1融合遺伝子陽性腫瘍に対する阻害効果を示すことが知られている*309。またレポトレクチニブ・セリトレクチニブなども開発が進行中である。
NTRK1、NTRK2、NTRK3の違いでの奏効率はほぼ同等と考えられている(承認申請資料に使用された複数臨床試験の統合データより)。
リキッドバイオプシーでは検出率が組織に比べて40〜50%程度に低下するとされている。
NTRKはfusionの相手次第で治療効果が大きく変わると考えられており、もともと希少ながんであるためfusionの相手遺伝子ごとの奏効率についてはデータは少ない。fusionがあっても蛋白質が生産されているかどうかや、それが機能を持つかどうかなどによって有効性が左右されているものと思われる。前臨床段階だがNTRK蛋白質を免疫染色するpanTRK染色でスクリーニングを行う方法の研究もなされている。STARTRKシリーズの臨床試験では文献のsupplimental data中でfusion相手の遺伝子のリストがあるほか、fusion相手で治療効果がどうであったかをまとめた報告が幾つかある*310。
エヌトレクチニブはFoundationOne CDxがコンパニオン診断薬として承認されているため、NCCオンコパネルでNTRK1変異などを検出した場合は保険適用とならない(ただしエキパネで承認され詳記を記載すればしばしば保険償還を認められる)。また、NCCオンコパネルにはNTRK3 fusionが検出できないなどの問題もあったが、2021年2月のNCCオンコパネルバージョンアップからこの問題は解決された。
以前はNTRK1は遺伝性腫瘍に関連する二次的所見として考慮すべきACMG遺伝子リストに含まれていたが、2019年から削除されたとのこと。
pan-TRK免疫染色との相関
NTRK fusionをゲノム的に検出する方法の他に免疫染色でこれをスクリーニングする方法の有効性が提示されています*311。この報告によると感度95.2%および特異度100%を示したとされています。NTRKが細胞質で染まる場合にfusionの存在を示唆します(核内が染まるのは非特異的所見)。一定の有効性はあるものの、fusionのない正常NTRKでも陽性となることがあるため最終的にはNGSでの裏付けが必要です。
また他にFISHを用いてNTRK fusionを検出する方法もありますが、これはfusionの相手となる遺伝子がわかっている必要があるのでマイナーfusionの場合は検出できないという問題があります。
TRK阻害剤耐性変異
NTRK融合遺伝子などに対するTRK阻害剤耐性変異のメカニズムも研究が進んでいる。たとえばNTRK1 p.G667CやNTRK3 p.G696Aなどgatekeeper部位のSNVがあるとラロトレクチニブやエヌトレクチニブの効果が乏しい*312。またBRAF V600EやKRAS変異などのMAPK経路の活性化変異、あるいはMET増幅などもTRK阻害剤の耐性変異として知られている。他にもいくつかTRK阻害剤の耐性変異に関する報告がある*313*314*315。
NTRK増幅
NTRK阻害剤の効果は染色体融合や再構成を対象にしているため増幅(amplification)は原則として対象外である。しかし症例報告レベルではNTRK1増幅食道癌に対するラロトレクチニブの有効性などが報告されている*316。ラロトレクチニブの保険適用対象とはならないが、エヌトレクチニブは患者申出療養の対象となる可能性がある。
p16過剰発現
免疫染色で見る因子であり遺伝子変異ではないが、頭頚部癌においてHPV関連腫瘍かどうかを推定するのに有用な因子。p16陽性であればHPV関連腫瘍であると考えられる。中咽頭癌では早期からp16陽性と予後良好の関連が示されており*317、また非中咽頭癌でもp16陽性が予後良好であることが示された*318。これらの研究ではHPV-DNAのPCR法との一致率は級内相関係数0.80とされておりある程度は信頼性がある検査と考えられているが、1割程度に不一致が見られる。
中咽頭癌などではp16の有無によってTNMのstagingも基準が変わるので非常に重要な因子である。
- 頭頸部外科2018 https://www.jstage.jst.go.jp/article/jjshns/28/1/28_9/_pdf
- がん情報サービス https://ganjoho.jp/public/cancer/mesopharynx/treatment.html
PALB2
HRDに関連する遺伝子で、家族歴のある乳癌や膵癌などで多数の報告あり。2020年夏頃までNCCオンコパネルのgermline変異検出対象遺伝子に含まれていなかったが2020年秋頃にgermline変異検出対象遺伝子に収載された*319。
PARP阻害剤
HRR前立腺癌387例に対するオラパリブを投与したRCTのPROfound試験ではPALB2変異が4例含まれており、この結果からPALB2を含むHRD前立腺癌に対するオラパリブがFDA承認されている*320。
またgermline/somaticのBRCA1/2またはPALB2に変異を持つ膵癌に対するPARP阻害剤ルカパリブの第2相試験でPFS 13.1ヶ月、OS 23.5ヶ月の好成績を示した。この結果により2022年3月からNCCNガイドラインでもPALB2変異陽性膵癌にルカパリブが推奨される。ただし本試験は全42例中PALB2変異は6例しかいなかったことからBRCA1/2などに比べてエビデンスは弱いと考えられ、またプラチナ感受性膵癌に限定した(前治療としてプラチナレジメンを実施して16週の無増悪が確認できた症例のみを対象とした試験)ことなど、解釈に注意が必要である*321。
PARP1
BRCA1/2変異に対して合成致死の関係にあるPARP阻害剤が有効であるが、逆にPARP変異の場合には推奨できる治療は現時点では無い(2022/5)。前立腺癌などでしばしば見られる。
PD-L1
PD-L1の別称であるCD274の欄を参照。
PDGFR
PDGFRα増幅症例では、パゾパニブがVEGFR-1、VEGFR-2、VEGFR-3、PDGFRα、PDGFRβ、c-Kitのリン酸化阻害をするため候補となりえる。症例報告はある*322が、強いエビデンスは無いようである。
PDGFRの免疫染色で強陽性を伴う皮膚癌(メルケル細胞癌)に対するイマチニブでCRの一例の症例報告がある*323。なおこの症例は免疫染色でのPDGFRα強陽性を確認しただけで、遺伝子シークエンス検査でのPDGFR増幅に関するNGSやFISHでの確認はされていないようである。なお、イマチニブを候補に考えるのはPDGFR単独で増幅を示している場合であり、KIT増幅を併発している場合はこれがイマチニブ耐性変異である可能性が考えられるなどの理由からPDGFR単独増幅以外の場合にはイマチニブを含むKIT阻害剤は推奨しにくい。
KIT変異陰性GISTではPDGFR D842Vなどのホットスポット変異があることが知られており、イマチニブやスニチニブは耐性があり無効*324である一方で、レゴラフェニブ*325・ダサチニブ*326・アバプリチニブ(avapritinib)*327の有効性が報告されている。ただしアバプリチニブは本邦未承認である。ソラフェニブ*328の有効症例報告もある。2023/11
PIK3CA
PI3K/AKT/PTEN経路に存在し、ER陽性乳癌の40%で変異が見られ、特にその変異の90%はE542K・E545K・H1047R・H1047Lのホットスポットに集中している*329。このパスウェイの活性化は乳癌のSERD以外の内分泌療法に対する耐性を生じさせうる(これに対してmTOR阻害剤が内分泌療法と併用される)。そのほかにアポトーシスとの関与、Ki67低下への関与、などが示唆されている。また、PIK3CAまたはPIK3CGの変異によるEGFR−TKI耐性はアスピリンにより克服できる可能性が示唆されている*330。
PIK3CA変異があっても必ずしもmTORの活性化は生じていないことが示唆されている*331。PI3K経路の遺伝子異常を有する主要に対してはC-CATやその他のデータベース参照結果からはmTOR阻害剤が推奨されることは多いが、PI3K系に対するmTOR阻害剤(エベロリムス)の第2相試験がネガティブであったことなどからPI3KはmTORパスウェイを阻害しても抗腫瘍効果を発揮できないのではないかと考えられている。
具体的な臨床試験のエビデンスとしては、2015年のSHIVA試験のmTORコホートで医師選択治療と比べてmTOR阻害剤はPFSを改善しないと結論され*332、また2017年にはエベロリムスの治療効果はPI3K経路の変異と関連しないとの報告*333も出されている。
上記のエベロリムスの結果に対して、第3相SOLAR-1試験の結果からアルペリシブは一定の有効性が期待されていたが現在は積極的には推奨されない。
ESMO2020の時点の発表*334では、ホルモン感受性乳癌に対するフルベストラントvsフルベストラント+アルペリシブを比較したところ統計学的有意差は無かったもののOSは30.8→39.2ヶ月と大きく延長しており、今後の長期フォロー解析の結果が待たれるところ。ただしアルペリシブは基本的に単独ではなくフルベストラントなどの内分泌療法と併用で効果を示すものであり、「ホルモン感受性乳癌以外の固形がん」に対する治療効果については慎重に判断する必要がある。ER依存性腫瘍以外に対するアルペリシブの有効性については、PIK3CA変異またはPTEN lossを有するTNBCのnabPTX±アルペリシブの第3相EPIK-B3試験が進行中*335。
第3相CAPItello-291試験の結果から、PIK3CA変異陽性乳癌に対してAKT阻害剤カピバセルチブがフルベストラントとの併用で2023年11月にFDA承認された*336。この試験ではSERD・mTOR阻害薬・PI3K阻害薬・AKT阻害薬の投与歴があると除外されていることに注意する。本邦ではカピバセルチブは未承認である。なお、米国ではコンパニオン検査としてはFoundationOne CDxが指定されている。2023/11
PI3CA H1047R
乳癌などで比較的高頻度に見られる変異の1つ。LOXO-783などの特異的阻害剤の臨床試験が進行中。その他にアルペリシブ+フルベストラントなどの併用療法が候補となる可能性がある*337。
ダブルPIK3CA変異
進行ER陽性乳癌に対するタセリシブ+フルベストラントを評価した第3相試験SANDPIPER試験の結果から、PIK3CA変異の数が1つの場合はORRに有意差がなかったがPIK3CA変異が2つ以上になる場合は奏効率が有意に高まる(プラセボ群に対して8.7→30.2%)と報告された*338*339。その基礎研究的な裏付けとして2019年にScienceに掲載された単一細胞シークエンスの結果からシスで同一アレルに2つ以上の変異が入った場合にPI3Kα阻害剤の感受性が増幅されることが報告されている*340。
抗HER2療法とPIK3CA
ASCO2020で発表されたKATHELIN試験(HER2陽性乳癌の標準術前化学療法でnon-pCRにT-DM1を追加した試験)のサンプルゲノム情報追加解析から、PIK3CA変異の有無は抗HER2療法の有効性には差がない可能性を示唆する結果あり。
EGFR-TKIとPIK3CA
EGFR変異陽性肺癌に対するEGFR-TKI治療中の獲得耐性を生じる二次的変異としてPIK3CA変異が見られることがある。一方で初期治療前から
EGFR変異とPIK3CA変異が両方見られる場合のPIK3CA変異はEGFR-TKI耐性には関与しないということも言われており、初期治療前からEGFR変異とPIK3CA変異が並存している場合はEGFR-TKIの投与を検討する。
PI3K/AKT/mTOR経路の変異を有する小細胞肺癌
臓器を小細胞肺癌に限定して、LC-SCRUM-Asiaでゲダトリシブの第2相試験が実施されている。
http://www.scrum-japan.ncc.go.jp/lc_scrum/trial/pi3kaktmtorgedatolisib_pf-05212384ii/index.html
POLE、POLD1
hypermutationに関与し、免疫チェックポイント阻害剤の奏効予測因子となり得る。大腸癌などでよく研究されている。
MSK-IMPACTのデータを用いた悪性黒色腫以外の皮膚腫瘍での探索的研究では、POLEとPOLD1の変異がある場合は免疫チェックポイント阻害剤を使用した際のOSが有意に長いとされており、またMSSやMSI-Lでも効果が見られると報告されている*341。大腸癌においてもPOLEとPOLD1の機能欠失変異についてはhypermutationを惹起するため免疫チェックポイント阻害剤を検討すべき因子と考えられている*342。また術前薬物療法として抗CTLA-4抗体と抗PD-L1抗体の併用療法を受けて完全奏効を示した報告もある*343。子宮内膜癌での研究では、POLE変異は免疫チェックポイント阻害剤の奏効を予測する有望なバイオマーカーであると報告されている*344。
POLE-pdとPOLE-pp
POLEは病的異議にあるPOLE-pdと病的異議のないPOLE-ppに分けられるという考えが広まりつつあり、将来的にはPOLE-pdのみを免疫チェックポイント阻害剤のバイオマーカーと考えるようになる可能性がある。なお、POLE-pdは大腸癌や子宮内膜癌で比較的よく見られるのに対して非小細胞肺癌や前立腺癌では稀であり、POLE変異でも臓器別に扱いを変える必要が出てくるかも知れない。詳細はこちら。
POLEやPOLD1のexonuclease domain
POLEやPOLD1の変異でも、exonuclease domainにあるかどうかによってその病的意義が変わるためそれに応じた分類を提唱するという報告*345がある。ClinVarで病的変異とされたものの中にもこの分類上は病的意義が乏しいという区分に該当するものもあるようであるため注意を要する。
POLE hotspot
POLE変異のうちでもP286R変異*346やV411L変異*347はホットスポットの1つとして知られており、hypermutationに関与したり免疫チェックポイント阻害剤の有効性予測マーカーであることが知られている*348*349*350。
またPOLE F367S変異を有する進行大腸癌にペムブロリズマブが著効した症例報告がある*351。
先天的にこれらの変異を持つ場合は消化管癌や膵癌・卵巣癌などの発症リスクが高いとされている塩基変異もある*352。その他にもいくつかの塩基が発癌に関連するものとして報告されている*353。
POLEとMSIの関連
大腸癌の網羅解析の報告では、POLE変異が見られる場合にはTMBは高値を示すが、その症例のほとんどMSI-HおよびCIMP、MLH1サイレンシングは陰性である*354。また上述のMSK-IMPACTのデータでもPOLEまたはPOLD1の変異がある場合はMSSやMSI-Lでも免疫チェックポイント阻害剤の有効性は高いとされている。MSIとは別の機序によるTMB増加要因と考えられる*355。
POLD2、POLD3
POLEとPOLD1に関連があるはずのPOLD2およびPOLD3などはhypermutationの原因遺伝子であるかどうか、免疫チェックポイント阻害剤の奏効予測バイオマーカーであるかどうかについてはこれまでコンセンサスには至っていないし、NCCオンコパネルおよびFoundationOne CDxの解析対象遺伝子にも含まれていない(2020年5月現在)。
PTCH1
PTCH1変異陽性に対してはSMO阻害剤(ソニデジブなど)の有効性が報告されているが国内では使用できない。
PTEN
がん抑制遺伝子で、PI3K/AKT/mTOR経路に関与。乳癌(luminal typeで4%、HER2で2%)など。C-CATレポートではエベロリムスが推奨されることはあるが、有効性を示唆するエビデンスが乏しく推奨されないことが多い。
PTEN loss
PTEN欠損去勢抵抗性前立腺癌ではAKT阻害剤イパタセルチブを抗アンドロゲン薬アビラテロンに上乗せすることでPFSの延長がある*356。また前立腺癌においてはPTEN欠損自体が抗アンドロゲン療法の奏効予測因子の可能性がある。
PTEN lossについてもエベロリムスが候補ではないかと推奨されることがあるが、乳癌ではBOLERO試験(のいずれか)のサブ解析でPTEN変異の有無にてエベロリムスの有効性の差がなかったことからPTEN変異の有無はエベロリムスのバイオマーカーとしては推奨しにくいと考えられている。骨肉腫ではソラフェニブ+エベロリムスの治療が検討されたことがあるが、これは骨肉腫全般に対する試験であってPTENのバリアントによる有効性を示したものでは無い。ただし乳癌などエベロリムスが保険承認されている臓器であれば(ゲノム診療としてではなく)標準治療として行うことは推奨される。
なお、PTENはがん抑制遺伝子であるのでPTEN lossが臨床的に影響を来すのはhomoのlossの場合のみではないかと考えられる。また広範な範囲のlossは二次的所見として開示しても確定診断が困難であったり介入の仕方が難しいことから開示対象としないことが妥当と判断されることがある。小杉班リストVer2.0では開示推奨度はAA。(FoundationOne CDxはheteroのlossは拾えずhomoのlossのみが検出されるという話あり)
進行乳癌においてPTENのnon-synonymous mutationやdeletionは免疫チェックポイント阻害剤の有効性が大きく落ち(奏効率48→6%)、PFS・OSともに短くなることが報告されている*357。また免疫染色でのPTEN欠失は、HER2陽性以外の早期乳癌の予後不良因子として知られている*358。
乳癌
第3相CAPItello-291試験の結果から、PIK3CA/AKT1/PTEN変異陽性乳癌に対してAKT阻害剤カピバセルチブがフルベストラントとの併用で2023年11月にFDA承認された*359。この試験ではSERD・mTOR阻害薬・PI3K阻害薬・AKT阻害薬の投与歴があると除外されていることに注意する。本邦ではカピバセルチブは未承認である。なお、米国ではコンパニオン検査としてはFoundationOne CDxが指定されている。2023/11
PIK3CA/AKT1/PTEN変異サブグループのトリプルネガティブ乳癌に対してAKT阻害剤イパタセルチブが第2相試験の結果から有望*360と考えられおり、第3相試験が進行中*361で2022年頃終了見込み。
遺伝性腫瘍(コウデン症候群、PTEN Hamartoma Tumor Syndrome)
生殖細胞系列のPTEN異常(欠失または機能喪失性変異)で生じる疾患はPTEN過誤腫症候群(PTEN Hamartoma Tumor Syndrome)とも称される一連の疾患群があるが、そのうちの代表はコウデン症候群(Cowden症候群)である。コウデン症候群は、皮膚・粘膜、消化管、乳腺、甲状腺、中枢神経、泌尿生殖器などに良性の過誤腫性病変が多発する。甲状腺癌(髄様癌>乳頭癌。他はまれ)、乳癌(生涯85%と高頻度)、子宮内膜(生涯で28%)には30-40歳ごろまでに良性or悪性の腫瘍を生じる。20代後半までに巨頭症、外毛根鞘腫、乳頭腫性丘疹、生殖器奇形、知的障害を生じるが必発の症状ではない。Bリンパ球の成熟障害により自己免疫疾患の発症と関連するとも指摘されている*362。なお、コウデン症候群のうちPTENに異常を認めるのは80%程度とされる。国内患者数は500-600人で比較的まれ。
https://www.shouman.jp/disease/html/detail/12_04_012.html
開示推奨度はAA、germline testの必要性は△で家族歴や本人の臨床所見などから疑わしい場合には考慮する(そうでない場合は必須ではなさそう)。
RAD51D
RAD51D機能欠失変異はPARP阻害剤およびプラチナ製剤の有効性につながる可能性がある。生殖細胞系列RAD51D変異を持つ卵巣癌に対してオラパリブが著効したという症例報告*363があるが、卵巣癌はもともとオラパリブの感受性がしばしば見られるためRAD51D変異に特異的な治療効果だったのかははっきりしない。またProFound試験の結果からBRCA1/2およびPALB2以外の遺伝子変異についてはPARP阻害剤の有効性は低いとの意見が強いようである。BRCAと同じようにreversion変異でRAD51Dの機能が回復するとPARP阻害剤に耐性となる*364。卵巣がんではRAD51D変異の頻度が高いとされる。
開示推奨度はAで、germline testの必要性は◎となっている。
なお、FoundationOne CDxでRAD51Dのframeshift(とくにコドン1〜8程度のリード領域のかなり前の部分に見られるもの)は日本人特有のSNPを拾い上げている偽陽性であることがしばしばあるので、これは有意な所見とは考えるべきではない(NCCオンコパネルではこの問題は生じないようである)。中外製薬によると、このRAD51D frameshiftの問題は修正予定とのこと。
RAD54L
機能喪失変位の場合は相同組み換え修復に関連し、PARP阻害剤およびプラチナ製剤の有効性に繋がると考えられる(ただしHRR関連遺伝子の中では比較的マイナーではある)。
RAF1
エビデンスは乏しいながら、レゴラフェニブとソラフェニブが治療候補として推奨されることがある。TAPUR試験ではGroup13でRAF1変異に対してレゴラフェニブが推奨されている*365。
またRAS/RAFよりもシグナル顆粒でコビメチニブの有効性を示すデータがある*366。コビメチニブは本邦未承認だが国内でアクセス可能なMEK阻害剤ではトラメチニブ、ビメニチニブが候補となる。トラメチニブは患者申出療養の候補。
RB1
網膜芽細胞腫の原因因子。二次的所見としては若年での家族歴がほぼ必発なので家族歴がなければ除外される。
RECTOR
推奨治療なし。
RET
RET変異固形がんに関するレビュー
https://mct.aacrjournals.org/content/20/10/1769
RETと同時に起こる遺伝子変異に関するレビュー
https://aacrjournals.org/mct/article/20/10/1769/665725/Hallmarks-of-RET-and-Co-occuring-Genomic
LIBRETTO-001試験で検討されたRET異常の甲状腺癌では、RET変異143例中57%はM918Tで8%はV804M/Lであり、またRET融合遺伝子27例でRET融合のパートナー遺伝子は、CCDC6が52%、NCOA4が33%であった*367*368。ほかにKIF5Bなども報告が多い。
甲状腺髄様癌の場合
甲状腺髄様癌の場合は先天的なRET変異が高頻度(甲状腺髄様癌の30%)に見られる。バンデタニブやセルペルカチニブ(以前はLOXO-292と呼ばれていた)の有用性が示され*369、2022年2月にRET変異陽性甲状腺髄様癌に本邦でもセルペルカチニブが承認された。そのほかにプラルセチニブなどが有用であるとの報告があり*370、プラルセリチニブ+セルペルカチニブの併用療法の臨床試験も進行中(2022/2)。
甲状腺髄様癌ではRET M918T変異(56〜60%)とRET CCDC6-RET融合遺伝子の頻度が非常に多い。その他にV804M/L変異(7〜9%)、D631-liter633delinsE、E632-liter633del、A883F、D631-liter633delinsV、L790F、D898-E901del、D898_E901del+D903_S904delinsEP、K666 N、T636-V637insCRT、D378-G385delinsE、また融合遺伝子としてはCCDC186-RET、ERC1-RET、KTN1-RET、RUFY3-RET、NCOA4-RET融合遺伝子などが知られている*371。このRET M918T変異に対しては第3相LIBRETTO-531試験でセルペルカチニブがバンデタニブorカボザンチニブに対して大きく優越性を示した*372。
甲状腺髄様癌の診療指針については「多発性内分泌腫瘍症診療ガイドブック」などを参照し専門医にコンサルテーションを行うこと。
RET融合遺伝子
RET異常(点突然変異または融合遺伝子)でカボザンチニブやバンデタニブに不応となった後治療の甲状腺癌*373とプラチナベース治療抵抗性となった非小細胞肺癌*374を対象にしたLIBRETTO-001試験の結果からセルペルカチニブ(LOXO−292)が候補となる。この結果を元にセルペルカチニブはRET融合遺伝子陽性非小細胞肺癌に対して2021年9月28日に*375、RET融合遺伝子陽性の切除不能な甲状腺癌に対して2022年2月*376に承認された。またRET遺伝子変異陽性甲状腺髄様癌に対して承認されている。
RET融合遺伝子については上記のセルペルカチニブの他に、第2相試験の結果からレンバチニブ*377、バンデタニブ*378が候補となる。ほかに、症例報告レベルではアレクチニブの報告*379がある。RET融合遺伝子ではカボザンチニブも治療候補となる*380。
RET変異(SNV,indel)
V804M/Lはバンデタニブに対する耐性変異であるがセルペルカチニブはV804M/Lに有効であるという小規模な報告がある*381。
RET増幅
RET増幅がRET阻害剤の治療標的となるかどうかはコンセンサスがないように思われる。一方でRET増幅を認めたグリオブラストーマに対するセルペルカチニブの有効症例は過去に報告されている*382。
家族性腫瘍(MEN2型)
RETの機能獲得型変異はMEN2型の原因遺伝子。すなわち甲状腺髄様癌、褐色細胞腫、副甲状腺を主たる症状とする常染色体優性遺伝性疾患である。上記3症状を示す2A型と、甲状腺髄様癌・褐色細胞腫・マルファン症候群、舌や口唇の粘膜下神経腫、腸管神経節腫などを示す2B型がある。2A型で浸透率の低い亜型は甲状腺髄様癌のみを示すことがあり、一方で甲状腺髄様癌の生涯浸透率はほぼ100%であるので、これは家族性甲状腺髄様癌(familial medullary thyroid carcinoma : FMTC)と呼ばれることもある。なお常染色体優性遺伝形式を取るものの、偶発的にRET変異が見つかる場合には父由来染色体の頻度が高いと言われている。
https://www.jstage.jst.go.jp/article/jaesjsts/32/4/32_267/_html/-char/ja
MEN2型の97%にRET遺伝子異常が見られる。2016年から甲状腺髄様癌に対するRET遺伝学的検査が保険収載されており*383、また現在の診療ガイドラインでもRETの評価が推奨されている。この場合は遺伝カウンセリングも考慮する。甲状腺髄様癌患者本人ではない「血縁者」もRET遺伝子異常を引き継いでいる場合は発がんリスクが高いのでRET遺伝子異常の有無を確認して変異があれば定期サーベイランスを受けることが望ましいが血縁者に対するRET遺伝学的検査は保険対象外。
二次的所見としてのRET変異が認められた際の対応について、欧州のガイドラインでは変異コドン別にもある程度のリスク分類がされている*384。2015年には米国でもガイドラインが出て変異コドン別のリスクが記載されるようになった*385。本邦のものではないことに注意で、本邦のガイドラインも参照すること。したがって、他の遺伝子変異と違って小杉班の資料だけではなく本邦及び欧米のガイドラインを参照して二次的所見の開示について検討することが望ましい。
- コドン609・768・790・791・804・891の変異が低リスクで甲状腺全摘時期についてはコンセンサスはない。MEN2Aの一部およびFMTCのすべて。
- コドン611・618・620・634が中リスクで5歳までに甲状腺全摘をすべき。MEN2Aの一部。
- コドン918・883・922の変異が高リスクで、甲状腺全摘の時期は生後1ヶ月までが望ましく、遅くとも生後6ヶ月までに実施する。副腎褐色細胞腫にも注意する。開示推奨度はAAA、germline testの必要性も◎。
ROS1
ROS1融合遺伝子を有する非小細胞肺癌でALK阻害剤クリゾチニブ、全臓器でNTRK阻害剤エヌトレクチニブが承認されている。この理由はROS1やNTRK1は、その活性中心であるチロシンキナーゼの構造がALKと非常に相同性が高いためとされている*386。また急性骨髄性白血病の治療薬であるギルテリチニブもROS1融合遺伝子陽性肺癌に有効性を示す*387。
ROS1融合遺伝子については、オンコマインDx Target TestマルチCDxシステムがクリゾチニブおよびエヌトレクチニブのコンパニオン検査*388として、FoudantionOne CDxがエヌトレクチニブのコンパニオン検査*389として、それぞれ承認されている。
SMAD4
有望な治療候補なし。ただしSMAD4欠失(deletion)の場合は免疫チェックポイント阻害剤の患者申出療養試験に参加できる可能性あり(要確認)。
TGF-βシグナルに関連し、膵癌のBIG4(KRAS、CDKN2A、TP53、SMAD4)の一つ。膵癌では18番染色体長腕のlossが高頻度に見られる。
germlineの変異であれば若年性ポリポーシス症候群(Juvenile polyposis)に関連するが、表現型の浸透率は高くはない?
SMARCA4
SMARCA4はBRG1の別称である。遺伝子変異はclass Iとclass IIにわけられる。
- class I:truncating変異(frameshift・nonsense変異), fusion, homozygous deletionなど機能喪失を招くもの
- class II:point mutation
SMARCA4の遺伝子異常をClass IとClass IIに分ける考え方が提唱されている*390。この報告によると、truncating変異, fusion, homozygous deletionなどをClass I変異とし、missense変異をClass II変異に分けられる。SMARKA4の機能は片アレルが残っていれば保たれるため、両アレルでの機能喪失が必要である(ただし現状のFoundationOne CDxのレポートなどでは、変異が片アレルなのか両アレルなのかはVAFから推測するしかない)。両アレルでの機能喪失であることを確認するため免疫染色レベルでの蛋白質の欠失を確認することは有用である。KRAS、STK11、KEAP1の遺伝子異常を要する症例はSMARCA4の変異陽性率と相関がある(Class I/IIとも)。2022/9
Class IのSMARCA4異常を有する症例は免疫チェックポイント阻害剤の有効性が高いため、SMARCA4はICIの奏効予測バイオマーカーの候補としても期待されていた。その背景としてSMARCA4変異があるとTMBが高くなるためとの報告がある。しかし、他の報告によるとSMARCA4異常の有無によって免疫チェックポイント阻害剤の有効性に差は無かったというコホート研究*391がある。またこの報告ではSMARCA4の変異がKEAP1/STK11と共存するとこのSMARCA4による特性は打ち消されるとも考察されている(症例数は少ないことに注意)。
SMARCA4のlossやS1382*などの機能喪失変異は肺癌などで多数の報告があるが治療奏効との関連に関する報告が乏しいため、これが本当に免疫チェックポイント阻害剤に対する治療予測バイオマーカーとして本当に意味があるものかどうかは疑問もある。免疫チェックポイント阻害剤を推奨するものとしては根拠が弱い印象がある。
極めて症例数が少ないためエビデンスは少ないものの、SMARKA4機能喪失性変異(≒class I変異?)ではEZH2阻害剤タゼメトスタットが有望の候補となり得る*392。作用機序などから考えるとこの有効性はSMARKA4変異がホモ(両アレル変異)がある場合に限られるが、前述のようにFoundationOne CDxでは変異が両アレルかどうかはレポートに記載されないため判別できない。SMARKA4はINI1蛋白質をコードするため免疫染色のINI1欠失も理論上はSMARKA4機能喪失性変異と同じ意味を示すと考えられる。
SMARCA4はシスプラチンを始めとするプラチナ系抗腫瘍薬の効果が高いとする報告がある*393。トポテカンやMTXの有効性に関する報告もある*394。KRAS変異とSMARCA4の変異をともに持つとICIの予後が悪いとの報告がある*395。CCND1との相関がありCDK4/6阻害剤の耐性が出現した際にSMARCA4変異が出現していることがある*396。
SMARCB1
両アレルのSMARCB1変異があるか、INI1の免疫染色欠失がある類上皮肉腫に対するタゼメトスタットの第2相で奏効率15%の報告がある*397。なお、INI1はSMARCB1遺伝子にコードされている蛋白質である。SMARCB1欠損を認める腫瘍は分化度が未分化・低分化であることがしばしばある。極めて有病率の低い希少がんであることからこの臨床試験の結果をもとに2020年にタゼメトスタットがFDA承認されている。
STK11(LKB1)
がん抑制遺伝子STK11はLKB1の別名。細胞周期やアポトーシスに関与する。HPV関連子宮頚癌で高頻度に異常が見られるとの報告もある*398。
現時点で確率された標的治療薬なし。STK11はmTORC1シグナル経路に関連するが、これまでの前臨床・早期段階の検討からmTOR阻害剤の有用性は乏しい*399。免疫チェックポイント阻害剤や放射線治療の耐性に関与するとの報告がある(後述)。
免疫チェックポイント阻害薬耐性
KRAS変異非小細胞肺癌に関する検討で、STK11(LKB1)変異を有する場合は抗PD-1療法の奏効率が有意に低かったとの報告がある(対照群が35.7%に対して7.4%)ことから、抗PD-1抗体に対する耐性に関与している可能性がある*400*401。肺癌のプラチナダブレットへのペムブロリズマブ上乗せ効果も得られにくいとの報告がある*402。一方で、これはKRAS変異非小細胞肺癌のみで見られる傾向で、KRAS野生型非小細胞肺癌ではSTK11やKEAP1は抗PD-1抗体療法の抵抗性と関連が見られないという報告もある*403。
いずれの報告も小規模の検討であることから、現時点でSTK11変異陽性の場合に免疫チェックポイント阻害剤の投与を差し控えるべきと言えるほどの強い根拠ではなさそう。
遺伝性腫瘍(Peutz-Jeghers症候群)
ポイツイエーガー症候群(Peutz-Jeghers症候群)はSTK11遺伝子変異を有する常染色体顕性遺伝疾患であり、全消化管の過誤腫性ポリポーシス、粘膜や四肢末端の色素斑を特徴とし、消化管癌・膵癌・子宮頚癌・乳癌に関連する。
神経系腫瘍を合併するターコット症候群(Turcot症候群)、消化管ポリポーシスと口腔内乳頭腫に甲状腺癌・乳癌・泌尿器系腫瘍を合併するコウデン症候群(Cowden症候群)と類似するが、鑑別されるべき別の疾患である*404。Turcot症候群はtype1とtype2に分けられ、type1はミスマッチ修復遺伝子異常に基づくリンチ症候群の亜型と考えられ、type2はAPC遺伝子異常に基づくと考えられる*405*406。Cowden症候群はPTEN不活化による。
TERT
TERT(特にTERTプロモーター領域変異)は中枢神経腫瘍や肝癌*407などの発症に関与するなど、多くの発癌に関与しているが有望な治療候補なし。特に肝癌ではHCV/HBV/非ウイルスを問わず30〜60%でTERT異常が認められ、ドライバー変異の1つと考えられている。分化型甲状腺癌などではTERT遺伝子変異陽性は予後不良であることが知られている*408。
エリブリンが有効という報告*409はあるものの確立されたものではなく、現時点では推奨される治療は無い。2022/11
TET2
現時点で標的治療薬なし。急性骨髄性白血病、急性リンパ性白血病、MDSなどの造血器腫瘍での変異頻度が高いほか、固形がんでは悪性黒色腫などで変異が見られる報告が散見される。
TP53
現状ではTP53変異に対する有望な治療薬はなさそう。C-CAT調査報告でドキソルビシンが提示されることがあるが、特定のTP53異常を標的とした前向きの検討で検証されたエビデンスはなく、がんゲノム医療としてTP53変異をもとにドキソルビシンを推奨する根拠は乏しいと思われる。
TP53 Y220C変異
TP53 Y220C変異のみを特異的に阻害する小分子化合物PC145861(レラザポプト)の第1相試験結果がASCO2022*410で、第1/2相PYNNACLE試験がSGO2024*411で発表され、卵巣癌・膵癌・乳癌などで有望な結果であった。(2024/03)
TP53とRB1の共変異
TP53とRB1の両者に機能欠失変異がある場合(言い換えればp53とRbの両者が不活性化されている場合)は未分化癌や小細胞癌などへの形質転換などを生じることが少なくなく、薬物療法の抵抗性や腫瘍の悪性度が高いことがしばしばある(肺癌の小細胞癌への形質転換などの例*412)。
遺伝性腫瘍(リフラウメニ症候群:Li-Fraumeni syndrome)
生殖細胞系列にTP53の病的変異のある場合はリ・フラウメニ症候群となり、様々なLFS関連腫瘍を発症する(軟部組織肉腫、骨肉腫、閉経前乳がん、脳腫瘍、副腎皮質癌、白血病、細気管支肺胞上皮がん)。30歳までに50%が、50歳までに60%が発癌するという報告もある。だが、実際にはTP53変異があっても全てが臨床的に意味のある変異というわけではなく臨床所見や家族歴が当てはまらないことからリ・フラウメニ症候群には該当しないことが少なくない。
古典的なリフラウメニ症候群は世界で400家系ほどしか報告されていなかったのに対してTP53の変異は2万人に1人程度見つかると言われており、偶然に発見されるTP53変異はリフラウメニ症候群ほどの病的な表現系を示さないということが示唆されている。またある報告*413では単遺伝子検査で拾い上げられるTP53変異に比べて多遺伝子パネル検査で拾い上げられるTP53変異は若年での発癌が少ないなど遺伝性腫瘍としての表現型が現れにくい傾向があったと報告され、このことから多遺伝子パネル検査で拾い上げられるTP53変異には臨床的には意義が低い(腫瘍発生率が乏しい)ものが含まれている可能性があるという意見がある*414。
古典的な診断基準
リ・フラウメニ症候群については古典的LFS症候群やChompret症候群という診断基準がある*415。変異アレル頻度が50%近くても、二次的所見と判定するためには家族歴での30歳以下で発症などの臨床的表現型が必要。
リフラウメニ症候群と放射線治療
リフラウメニ症候群の場合は放射線治療が晩期の二次性発癌を誘発するために根治的放射線治療は極力避ける必要がある*416。たとえば乳癌診療ガイドライン2018では、術後に放射線治療が必要となる乳房部分切除よりも乳房全摘が推奨される旨が明記されている*417。なお、放射線治療が絶対的禁忌ではなく、晩期毒性よりも喫緊の症状緩和が優先されるような疼痛緩和目的の放射線照射についてはこの限りではない。
古典的な「狭義のリフラウメニ症候群」と「リフラウメニ様症候群」
古典的には狭義の「リフラウメニ症候群」と類縁疾患の「リフラウメニ様症候群」が区別されていて、前者は「発端者が 45 歳以前に肉腫と診断され、かつ一度近親者に45歳未満に診断されたがん患者があり、かつ一度もしくは二度近親者に45歳未満のがん患者あるいは年 齢を問わない肉腫患者がある」と定義され、肉腫・乳癌・脳腫瘍・副腎皮質癌・白血病を有する場合はリフラウメニ様症候群とされていたが、最近ではその両者は区別されないことも増えている。
TP53BP1
DNA損傷応答蛋白質の1つ。TP53BP1が欠損している腫瘍では、BRCA1欠損腫瘍に対するPARP阻害剤に耐性となる*418。TP53BP1そのものに対する標的治療はまだ開発されていない。
なお、TP53BP1は2022年8月からFoundationOne CDxで検出対象の遺伝子となったが、軽微な保険条件の変更のために解析結果レポートには掲載されないとのこと(XMLファイルに掲載されるのみ)。2022/08
TSC2
現時点では有望な治療標的なし。mTORパスウェイに属するがん抑制遺伝子であるため機能喪失性変異ではmTOR阻害剤の有効性があるのではという推定に関しても、これを支持する有効性の報告や現在進行形の臨床試験なども存在しないようである(2023/6)。
VEGFA
ソラフェニブなどのマルチキナーゼTKIを考慮。
VHL
腎癌の60-70%を占める淡明細胞癌で58%にVHL異常が見られたとの報告がある*419。VHL異常がある場合は腫瘍のHIF分解作用が低下しVEGFなどの腫瘍増殖に関与する因子が過剰生産される。
von Hippel–Lindau(VHL)病を背景とする腎細胞癌に対しては2021年から経口HIF-2α阻害剤ベルズチファンが奏効率49%と良好な成績を示してFDA承認されている*420が、本邦では未承認である。かつてVHLはエベロリムスなどのmTOR阻害剤が有用であると考えられていたようだが、現在はVHL変異はエベロリムスの奏効関連バイオマーカーではないとの考え方が一般的のようであるので推奨されない。
二次的所見
生殖細胞系列にVHL異常が見られる場合は、Von Hippel-Lindau病(常染色体優性遺伝)と、多血症(常染色体劣性遺伝)の原因遺伝子と考えられる。両者が重なることもある。Clinvarで調べるときは、どちらの疾患に対してpathogenicなのかを区別する必要がある(たとえば多血症に対してpathogenicだが、Von Hippel-Lindau病に対してはconflictingとなるような変異もある)。
Von Hippel-Lindau病では腎癌、膵腫瘍、精巣上体腫瘍、褐色細胞腫(褐色細胞腫はII型のみ)、中枢神経や網膜の血管腫などが指摘されており、特に腎細胞癌(30代後半ごろに発症)と膵腫瘍は生命予後を左右する因子。ただし、ESMOの推奨では腎癌で見つけられたVHLは大部分が体細胞変異なので腎癌に関してはVHLは生殖細胞系列と考える必要はあまりない(参考記事)。
開示推奨度はAAA、germline testの必要性も◎。
WT1
ウィルムス腫瘍(小児の腎芽腫)に関連するほか、急性骨髄性白血病で過剰発現が高頻度に見られる。WT1陽性腫瘍は予後不良である。
現時点では確率された標準治療は無し。将来的にWT1ペプチド癌ワクチンが実用化されることが期待されている。
レビュー https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3987486/
リキッドバイオプシーでの治療推奨について
FoundationOne Liquid CDxはFoundationOne CDxに比べて治療推奨しがたいカテゴリがいくつかある。
- MSI-H:薬事承認外
- blood TMB:薬事承認外、リキッドと組織のconcordanceに対するデータが不足
- 増幅や欠失などのCNA(コピー数異常):薬事承認外、リキッドと組織のconcordanceに対するデータが不足
- FGFR2融合遺伝子などのいくつかの融合遺伝子:コンパニオン承認を得ていない
Loss of Heterozygousity / Heterozygous loss / LOH score
広範囲にLOHが見られるものは相同組換え修復異常(HRD)の指標とされており、多発性骨髄腫*421や卵巣癌*422などでPARP阻害剤の治療標的の候補となることが報告されている。腹膜癌でもPARP阻害剤が有効との報告もある。一方でPARP阻害剤の奏効予測因子にはなるが、PARP阻害剤を投与したときの予後に差はなく、予後予測因子にはならないとの報告もある*423。現時点ではLOH scoreが高いというだけではPARP阻害剤を推奨していないエキスパートパネルが多そうな印象(2021年7月)。
FoundationOne CDxのLoss of Heterozygousity scoreのカットオフ値は16%となっている。2022年6月から、FoundationOne CDxではLOH scoreが16%以上の場合はHomologus Recombination statusがpositiveと表示されるようになった。
本邦ではLOH scoreはFoundationOne CDxレポートには掲載されるが、薬事承認の対象範囲外とされている(したがってFoundationOne Liquid CDxにおけるamplificationなどと同様で患者申出療養などの対象とならないと思われる)。2022/09
TMB-H
UMIN000033182などTMB-Hに対するペムブロリズマブの多施設共同第II相試験が進行中(これはリキッドバイオプシーでのTMB-Hが対象)。
2020年4月にFoundationOne CDxのTMBスコア10以上に対するペムブロリズマブがFDAに承認申請された*424。これはESMO2019で発表されたKEYNOTE-158の追加解析による。MSI-H固形がんを除外すると、TMB-H群では奏効率が27.1%に対して非TMB-H群で奏効率が6.7%にとどまった。
追記(2020.6.17):FDAがこのTMB 10mut/Mb以上についてペムブロリズマブを承認したと報じられた。
https://seekingalpha.com/news/3583617-fda-oks-mercks-keytruda-for-second-application-based-on-biomarker
TMBの変異頻度別の奏効率はAACR21で発表されているものがある。
https://twitter.com/PTarantinoMD/status/1381700525549305858
この研究は「免疫チェックポイント阻害薬が比較的よく効きそうな臓器の腫瘍」が多く含まれていることやTMBがギリギリ10というよりは十分に高い症例が多いことから、解釈には注意が必要。また、この解析では10種類の癌腫が対象とされており、小細胞肺癌(34.3%)、子宮頚癌(16.2%)、子宮体癌(15.2%)、肛門管癌(14.1%)などがTMB-H群に多く見られた一方で、非TMB-H群では悪性中皮腫・神経内分泌腫瘍・唾液腺癌などが多く含まれていた。TMB-H群には免疫チェックポイント阻害剤の有効性が期待できそうな癌腫が多く含まれていることについて疑問を呈する声もあるようである。
一方で、ESMO2019でなされた非小細胞肺癌でTMB-Hはペムブロリズマブの治療効果の関連について検討した発表*425から、奏効予測バイオマーカーではないとのリリースもされている*426。
TAPUR試験ではTMBのカットオフ値は9で乳癌は良い結果を出している。
ASCO2020でもKEYNOTE-119の付随研究から再発TNBCでTMB 10をカットオフ値としてペムブロリズマブが有効であると報告されている*427が、その内訳を見るとORRはTMB 10未満が12.7%に対して14.3%となっていてその差は微々たるものであり、TMBが有望なバイオマーカーとは言いがたい印象。また、この報告ではPFSとOSはむしろ短い傾向(1.24→1.14ヶ月、0.81→0.58ヶ月)であった。
TMB-Highに対するイピリムマブ+ニボルマブの併用療法については、小規模ながらイピリムマブ併用のバイオマーカーとはならないことを示唆する報告がある*428。このことからCTLA-4抗体の併用ではなく抗PD-1抗体単独が推奨されることが標準的である。
FoundationOne CDxのTMBカットオフ値
従来はFoundationOne CDxのTMB-Hはカットオフ値を20としていたが、このKEYNOTE-158の追加解析を始めとしていくつかの研究はカットオフ値を10と定義して解析を行っているため、今後はFoundationOne CDxのTMBスコアカットオフ値は10になってゆくものと推測される。
ネオアンチゲンを作るのはエクソン部分だが、実臨床ではFoundationOne CDxのTMBスコアなどイントロンも含めたTMBによってエビデンスが作られているのが現状である。またC-CATレポートでもTMB 10/Mbでペムブロリズマブを推奨に提示するようになっている。ただしペムブロリズマブを推奨するかどうかとは別でレポート上の表記としては10〜16/MbはIntermediateと記載され、16/Mb以上でHighと判定される。(2021年6月)。
DNA damage response gene alterations are associated with high tumor mutational burden and clinical benefit from programmed death 1 axis inhibition in non-small cell lung cancer.
https://ascopubs.org/doi/abs/10.1200/JCO.2019.37.15_suppl.9077
FoundationOne CDxの「TMB:Cannot be determined」について
FoundationOne CDxのTMBは正しく判定されず「Cannot be determined」と報告されることがあるが、この理由にはいくつかのものが挙げられる。代表的なものを下記に挙げる。
- 検体不良などの問題。たとえば検体が古くDNA断片化が進んでいるケース。
- TMBを判定するのに必要なカバレッジが十分でなかった場合。これも検体不良によって起こり、検体が小さすぎるなどの理由でDNA量が少なすぎる場合、検体がか古い場合、保存状態が悪い場合に起こりえる。
- 正常リンパ球が組織中に多量に混在している場合は腫瘍細胞DNAの比率が相対的に下がってしまうため、Low Tumor PurityとしてTMBが報告保留とされることがある。腫瘍細胞含有率が低い検体の場合にこのような判定となることが多いように思われる*429。
Sensitivity reduced caseの注意書き
FoundationOne CDxでは、検体量が不足していたり品質に問題があるが検査そのものは実施可能な場合は、Sensitivity reduced caseという注釈が付いた上で条件付きレポートが作成されることもあります。
AmplificationのEquivocalのカットオフ値
2018年版のFoundationOne CDx Technical Informationでは、がんゲノムプロファイリング検査としてはERBB2のカットオフ値は5、その他の遺伝子ではカットオフ値は6となっている*430。しかし、2022年時点の情報では増幅のコピー数のカットオフ値は2倍体の場合は6コピー以上で、3倍体・4倍体などの場合は腫瘍の倍数性+4コピー以上(3倍体で7コピー)となっている*431。
ただしERBB2のコンパニオン診断機能のカットオフ値は別で設定されていて、2倍体の場合は5コピー以上(もしくはベースラインにおける腫瘍の倍数性+3コピー以上)となっている。
https://www.pathology.or.jp/news/20231218_guidance20221228.pdf
FoundationOne CDxは腫瘍細胞含有率が20%以上の献体を用いることとなっているが、コピー数異常(増幅や欠失)の場合は検出確率95%となるための腫瘍細胞含有率は25.3%であり、それを下回る場合は検出感度が下がるとされている。

exon単位以上の大きなlossについて
二次的所見として可能性がある遺伝子欠失について、exon単位以上の大きな領域で欠失が見られる場合は現状では(多くの遺伝子で)その欠失を確定診断したり血縁者にそのバリアントを受け継いでいるかどうかの検証が困難であることが多いため(別の言い方をすればactionableではないため)、開示対象としないと判断することがある。
non-canonical fusion
FoundationOne CDxで融合遺伝子についてnon-canonical fusionという表記が付記されることがある。non-canonical fusionは直訳すれば非典型的融合遺伝子、つまり比較的稀な融合遺伝子と考えられる。同様の変異の報告例がなかった場合には、そのfusionがinframeかどうか、活性ドメインを含む融合遺伝子か、などから総合的に判断せざるを得ないことが多い。
*1 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-capivasertib-fulvestrant-breast-cancer
*2 JCO 2019. https://ascopubs.org/doi/pdf/10.1200/JCO.19.00368
*3 Ann Oncol 2019. https://ascopubs.org/doi/pdf/10.1200/JCO.19.00368
*4 Lancet Oncol 2020. https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(19)30817-4/fulltext
*5 Eur J Cancer 2018. https://www.ejcancer.com/article/S0959-8049(18)31515-6/fulltext
*6 NEJM 2021 https://www.nejm.org/doi/full/10.1056/NEJMc2101264
*7 https://www.jfcr.or.jp/laboratory/news/8217.html
*8 Nat commun https://www.nature.com/articles/s41467-021-21396-w
*9 https://pubmed.ncbi.nlm.nih.gov/18724359/
*10 https://cancer.qlife.jp/series/as005/article9069.html
*11 NEJM https://pubmed.ncbi.nlm.nih.gov/26698910/
*12 Front Oncol 2021. https://www.frontiersin.org/articles/10.3389/fonc.2021.713530/full
*13 http://gi.org/guideline/genetic-testing-and-management-of-hereditary-gastrointestinal-cancer-syndromes/
*14 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1773237/
*15 http://gi.org/guideline/genetic-testing-and-management-of-hereditary-gastrointestinal-cancer-syndromes/
*16 Clinical and Translational Oncology 2022 https://link.springer.com/article/10.1007/s12094-022-02856-1
*17 https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1437
*18 https://www.jges.net/wp-content/uploads/2024/03/e61aad662b27e9417ea75179604eb8ac.pdf
*19 Ann Oncol 2018 https://www.sciencedirect.com/science/article/pii/S0923753419454525
*20 https://medical.nikkeibp.co.jp/leaf/all/cancernavi/news/202206/575478.html
*21 ASCO2022 https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.16_suppl.6079
*22 JCI 2014 https://pubmed.ncbi.nlm.nih.gov/24569458/
*23 https://www.esmo.org/oncology-news/antitumour-activity-of-ceralasertib-in-arid1a-deficient-solid-tumours
*24 NEJM 2020 https://www.nejm.org/doi/full/10.1056/NEJMoa2022485
*25 https://medical.nikkeibp.co.jp/leaf/all/cancernavi/news/202004/565282.html
*26 Lancet Oncol 2022 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(21)00757-9/fulltext
*27 Jensen K JAMA Oncol https://jamanetwork.com/journals/jamaoncology/fullarticle/2772786
*28 https://products.sysmex.co.jp/products/genetic/AK401170/OncoGuideNCC.pdf
*29 NCCN. Clinical practice guidelines in oncology:BREAST CANCER, version 1.2018.
*30 JCOPO 2021 https://ascopubs.org/doi/abs/10.1200/PO.20.00334
*31 Lancet Oncol 2022 https://www.thelancet.com/journals/lanonc/article/PIIS1470-20452200277-7/fulltext
*32 https://ascopubs.org/doi/abs/10.1200/JCO.2020.38.15_suppl.9058
*33 JTO 2021 https://www.jtocrr.org/article/S2666-3643(21)00090-4/fulltext
*34 https://ascopubs.org/doi/10.1200/JCO.2022.40.16_suppl.3122
*35 NPJ precision oncology 2022 https://www.nature.com/articles/s41698-022-00291-7
*36 Nature 2017 https://pubmed.ncbi.nlm.nih.gov/28783719/
*37 https://cancerdiscovery.aacrjournals.org/content/9/3/329.full-text.pdf
*38 NEJM 2019 https://www.nejm.org/doi/full/10.1056/NEJMoa1908075
*39 Nat Med 2023 https://www.nature.com/articles/s41591-023-02321-8
*40 Lancet Oncol. https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(20)30321-1/fulltext
*41 JTO 2021 https://www.jto.org/article/S1556-0864(21)02403-5/fulltext
*42 日本内分泌・甲状腺外科学会雑誌 2020 https://www.jstage.jst.go.jp/article/jaesjsts/37/2/37_110/_html/-char/ja
*43 JCO 2018 https://pubmed.ncbi.nlm.nih.gov/29072975/
*44 NEJM 2023 https://www.nejm.org/doi/full/10.1056/NEJMoa2303815
*45 https://www.annalsofoncology.org/article/S0923-7534(19)45234-4/fulltext
*46 JCO 2023 https://ascopubs.org/doi/full/10.1200/JCO.22.01000
*47 Cancer Cell 2020 https://pubmed.ncbi.nlm.nih.gov/32289278/
*48 Cancer Cell 2017 https://pubmed.ncbi.nlm.nih.gov/28966033/
*49 Clin Cancer Res 2020 https://pubmed.ncbi.nlm.nih.gov/31924734/
*50 The Oncologist 2021 https://theoncologist.onlinelibrary.wiley.com/doi/10.1002/onco.13795
*51 Clin Cancer Res 2020 https://pubmed.ncbi.nlm.nih.gov/31924734/
*52 Oncotarget 2020 https://www.oncotarget.com/article/27788/text/
*53 https://ascopubs.org/doi/pdf/10.1200/JCO.19.00489
*54 JCOPO 2022 https://ascopubs.org/doi/pdf/10.1200/PO.22.00075
*55 https://www.ncbi.nlm.nih.gov/pubmed/28927118
*56 Oncogene 2018;37:1775-87.
*57 https://pubmed.ncbi.nlm.nih.gov/33842313/
*58 https://www.ncbi.nlm.nih.gov/pubmed/26153495
*59 Clin Cancer Res 2020 https://pubmed.ncbi.nlm.nih.gov/31924734/
*60 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5049644/
*61 https://pubmed.ncbi.nlm.nih.gov/31519698/
*62 https://pubmed.ncbi.nlm.nih.gov/32991018/
*63 JCOPO https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8407652/
*64 https://pubmed.ncbi.nlm.nih.gov/32991018/
*65 WCGC2020 https://medical.nikkeibp.co.jp/leaf/mem/pub/search/cancer/news/202007/566265.html
*66 Gynecol Oncol https://pubmed.ncbi.nlm.nih.gov/26723501/
*67 Clin Cancer Res https://pubmed.ncbi.nlm.nih.gov/26187614/
*68 https://clinicaltrials.gov/ct2/show/NCT04644068
*69 ESMO breast 2020. https://oncologypro.esmo.org/meeting-resources/esmo-2019-congress/Phase-3-study-of-veliparib-with-carboplatin-and-paclitaxel-in-HER2-negative-advanced-metastatic-gBRCA-associated-breast-cancer
*70 ESMO2019
*71 NEJM 2015 1697-1708 https://www.nejm.org/doi/full/10.1056/NEJMoa1506859
*72 https://www.fda.gov/drugs/fda-grants-accelerated-approval-rucaparib-brca-mutated-metastatic-castration-resistant-prostate
*73 https://www.cancernetwork.com/view/clinical-efficacy-of-nivolumab-plus-rucaparib-revealed-in-mcrpc-subgroup
*74 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7555445/
*75 https://pubmed.ncbi.nlm.nih.gov/32795228/
*76 https://www.clinicaltrials.gov/ct2/show/NCT02229656
*77 JNCI 2015 https://pubmed.ncbi.nlm.nih.gov/26315354/
*78 学会発表のみで論文化は未 @2021.3 https://www.cancertherapyadvisor.com/home/news/conference-coverage/american-association-for-cancer-research-aacr/aacr-2019/nci-match-breast-cancer-no-response-palbociclib-ccnd/
*79 Modern Pathol https://www.nature.com/articles/modpathol2013209
*80 JCO 2022 https://pubmed.ncbi.nlm.nih.gov/36469840/
*81 Nature 2022 https://www.nature.com/articles/s41586-022-04638-9
*82 BMJ 2021 https://jitc.bmj.com/content/9/5/e002680
*83 Nat Med 2021 https://pubmed.ncbi.nlm.nih.gov/33462450/
*84 JAMA Netw Open 2020 e2011818 https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2770741
*85 JTO 2023 https://www.jto.org/article/S1556-0864(23)00482-3/fulltext
*86 Clin Cancer Res 2018 3282-3291 https://pubmed.ncbi.nlm.nih.gov/29351920/
*87 https://aacrjournals.org/cancerdiscovery/article/8/4/498/9660/E-Cadherin-ROS1-Inhibitor-Synthetic-Lethality-in
*88 https://clinicaltrials.gov/ct2/show/NCT03620643
*89 http://grj.umin.jp/grj/hdgc.htm
*90 https://www.annalsofoncology.org/article/S0923-7534(22)01167-X/fulltext
*91 J Clin Oncol 2013 https://pubmed.ncbi.nlm.nih.gov/23569312/
*92 https://pubmed.ncbi.nlm.nih.gov/32593094/
*93 https://pubmed.ncbi.nlm.nih.gov/32955174/
*94 https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/208558s014lbl.pdf
*95 JCOPO 2020 https://ascopubs.org/doi/full/10.1200/PO.19.00399
*96 Oncologist 2019 1526-1533
*97 Cell 2018;173: 1770–1782.e14.
*98 https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.6_suppl.103
*99 Cancer Medicine 2022 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8817093/
*100 JNCCN 2021 https://jnccn.org/view/journals/jnccn/19/8/article-p905.xml
*101 Cancer Research 2022 https://aacrjournals.org/cancerres/article/81/1/18/647808/Targeting-CDK12-for-Cancer-Therapy-Function
*102 JCOPO 2019. https://www.tapur.org/sites/tapur.org/files/Palbociclib_in_Patients_With_Pancreatic_and_Biliary_Cancer_With_CDKN2A_Alterations.pdf
*103 https://ascopubs.org/doi/10.1200/PO.19.00124
*104 JCOPO 2020. https://ascopubs.org/doi/abs/10.1200/PO.20.00037
*105 https://ascopubs.org/doi/10.1200/JCO.2021.39.15_suppl.6043
*106 Lancet oncol 2022 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(22)00062-6/fulltext
*107 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368081/
*108 https://www.nature.com/articles/nrurol.2017.179/tables/2
*109 Int J Cancer 2017 https://www.ncbi.nlm.nih.gov/pubmed/28748527
*110 Cancer Sci 107:1179-86, 2016
*111 BMC cancer https://bmccancer.biomedcentral.com/articles/10.1186/s12885-019-5820-0
*112 https://ascopubs.org/doi/abs/10.1200/JCO.2020.38.15_suppl.9513
*113 https://www.takeda.com/siteassets/jp/home/investors/report/quarterly-announcements/fy2019/j_3---tak-788-rd-day_final.pdf
*114 https://pubmed.ncbi.nlm.nih.gov/24353160/
*115 Cancer Genet 2021 https://pubmed.ncbi.nlm.nih.gov/33901930/
*116 Lung Cancer 2018 https://pubmed.ncbi.nlm.nih.gov/29858019/
*117 Respirol Case Rep 2019 https://pubmed.ncbi.nlm.nih.gov/31007929/
*118 Nature 2021 https://www.nature.com/articles/s41586-021-03898-1
*119 https://www.info.pmda.go.jp/downfiles/md/PDF/840863/840863_23000BZX00089000_B_01_12.pdf
*120 https://medical.nikkeibp.co.jp/inc/mem/pub/search/cancer/news/202109/571892.html
*121 JAMA oncol 2021 https://jamanetwork.com/journals/jamaoncology/fullarticle/2784882
*122 https://www.takeda.com/jp/newsroom/newsreleases/2023/20231003_8402/
*123 https://clinicaltrials.gov/ct2/show/NCT03318939
*124 https://www.ncc.go.jp/jp/ncce/division/clinical_trial/ctas/patient/list/lung/130.html
*125 JCO 2023 https://ascopubs.org/doi/abs/10.1200/JCO.23.00152
*126 Sci Transl Med 9:eaan6566 2017
*127 JTO 2021 https://www.jto.org/article/S1556-0864(15)35094-2/fulltext
*128 Clin Cancer Res 2023 https://aacrjournals.org/clincancerres/article/doi/10.1158/1078-0432.CCR-22-2189/726107/Osimertinib-and-Selpercatinib-Efficacy-Safety-and
*129 JAMA Oncol 4:1527-1534, 2018
*130 JTO 2023 https://www.jto.org/article/S1556-0864(23)02372-9/fulltext
*131 https://www.nature.com/articles/ncomms14768
*132 https://pubs.acs.org/doi/10.1021/acsmedchemlett.8b00314
*133 Am J Cancer Res 2020 https://pubmed.ncbi.nlm.nih.gov/33294282/
*134 Cancer Discov 2018 https://aacrjournals.org/cancerdiscovery/article/8/2/164/6256/Genomic-Landscape-of-Cell-Free-DNA-in-Patients
*135 J Thorac Oncol 13:1138-1145, 2018
*136 NEJM 2005 133-144 https://www.nejm.org/doi/full/10.1056/NEJMoa050736.
*137 http://ar.iiarjournals.org/content/36/1/455
*138 Cancer Res 2017 https://pubmed.ncbi.nlm.nih.gov/28202511/
*139 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(15)00021-2/fulltext
*140 Cancer Discov 2018 https://cancerdiscovery.aacrjournals.org/content/8/6/696.full
*141 JCOPO https://ascopubs.org/doi/10.1200/PO.18.00310
*142 PNAS 2006 https://pubmed.ncbi.nlm.nih.gov/16672372/
*143 Oncotarget 2020 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7275784/
*144 J neurooncol 2021 https://pubmed.ncbi.nlm.nih.gov/34498213/
*145 Anticancer Res. 2007 https://pubmed.ncbi.nlm.nih.gov/17970081/
*146 Radiother Oncol. 2009 https://pubmed.ncbi.nlm.nih.gov/19616334/
*147 https://www.ncbi.nlm.nih.gov/books/NBK1211/
*148 https://www.pathology.or.jp/news/20231218_guidance20221228.pdf
*149 ./?0bde35867f#t00e4549
*150 JCO 2023 https://ascopubs.org/doi/full/10.1200/JCO.23.02005
*151 Lancet Oncol 2024 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(24)00064-0/abstract
*152 JCO 2023 https://ascopubs.org/doi/10.1200/JCO.2023.41.16_suppl.3501
*153 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-unresectable-or-metastatic-her2
*154 https://www.sciencedirect.com/science/article/pii/S0923753419417249
*155 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(18)30904-5/fulltext
*156 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(21)00336-3/fulltext
*157 https://www.clinicaltrials.jp/cti-user/trial/ShowDirect.jsp?japicId=JapicCTI-194707&language=ja
*158 JCOPO 2020 https://ascopubs.org/doi/pdf/10.1200/PO.19.00333
*159 JCO 2023 https://ascopubs.org/doi/full/10.1200/JCO.23.02005
*160 https://pubmed.ncbi.nlm.nih.gov/22374460/
*161 NEJM 2021 https://www.nejm.org/doi/full/10.1056/NEJMoa2112431
*162 https://www.mskcc.org/cancer-care/clinical-trials/21-239
*163 Front Oncol 2020 https://www.frontiersin.org/articles/10.3389/fonc.2020.01162/full
*164 https://pubmed.ncbi.nlm.nih.gov/29146616/
*165 https://ascopubs.org/doi/full/10.1200/PO.20.00114
*166 J Mol Diagn 2015. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6136063/
*167 J Oncol https://www.hindawi.com/journals/jo/2020/6375956/
*168 第2相ETOP試験。J Thorac Oncol 2019 https://pubmed.ncbi.nlm.nih.gov/30825613/
*169 Nature 2018 https://pubmed.ncbi.nlm.nih.gov/29420467/
*170 https://www.precisiononcologynews.com/molecular-diagnostics/thermo-fisher-scientific-hengrui-therapeutics-ink-cdx-deal-pyrotinib-her2
*171 JCO 2021 https://pubmed.ncbi.nlm.nih.gov/34550757/
*172 https://clinicaltrials.gov/ct2/show/NCT03318939
*173 https://www.ncc.go.jp/jp/ncce/division/clinical_trial/ctas/patient/list/lung/130.html
*174 JCO 2016 https://pubmed.ncbi.nlm.nih.gov/27044931/
*175 https://www.onclive.com/view/her3-emerges-as-intriguing-treatment-target-in-lung-cancer
*176 Ann Oncol 2023 https://www.annalsofoncology.org/article/S0923-7534(23)00685-3/fulltext
*177 https://jbcs.xsrv.jp/guidline/2018/index/yakubutu/y2-fq-21/
*178 https://www.ncbi.nlm.nih.gov/pubmed/26560360
*179 https://www.jstage.jst.go.jp/article/jaesjsts/36/2/36_96/_article/-char/ja/
*180 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5063698/
*181 https://medical.nikkeibp.co.jp/leaf/mem/pub/search/cancer/news/201403/535553.html
*182 https://www.spandidos-publications.com/10.3892/ol.2017.5946
*183 https://pubmed.ncbi.nlm.nih.gov/26954701/
*184 https://clincancerres.aacrjournals.org/content/22/1/259
*185 https://pubmed.ncbi.nlm.nih.gov/35344029/
*186 https://pubmed.ncbi.nlm.nih.gov/30257990/
*187 https://pubmed.ncbi.nlm.nih.gov/29223982/
*188 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-pemigatinib-cholangiocarcinoma-fgfr2-rearrangement-or-fusion
*189 J Gastroenterol 2021 https://link.springer.com/article/10.1007/s00535-020-01735-2
*190 Lancet Oncol https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(20)30109-1/fulltext
*191 https://www.jnj.com/media-center/press-releases/balversa-erdafitinib-receives-u-s-fda-approval-for-the-treatment-of-patients-with-locally-advanced-or-metastatic-urothelial-carcinoma-with-certain-fgfr-genetic-alterations
*192 NEJM 2019 https://www.nejm.org/doi/full/10.1056/nejmoa1817323
*193 https://aacrjournals.org/cancerres/article/83/8_Supplement/CT016/725419/Abstract-CT016-Clinical-and-translational-findings
*194 JNCCN 2023 https://jnccn.org/view/journals/jnccn/21/2/article-px.xml
*195 https://bmccancer.biomedcentral.com/articles/10.1186/s12885-022-09478-4
*196 NEJM 2019 https://www.nejm.org/doi/full/10.1056/NEJMoa1817323
*197 https://www.mdanderson.org/newsroom/targeted-therapy-erdafitinib-effective-for-patients-with-advanced-bladder-cancer-and-specific-gene-mutations.h00-159304623.html
*198 https://www.jnj.com/media-center/press-releases/balversa-erdafitinib-receives-u-s-fda-approval-for-the-treatment-of-patients-with-locally-advanced-or-metastatic-urothelial-carcinoma-with-certain-fgfr-genetic-alterations
*199 https://aacrjournals.org/cancerres/article/83/8_Supplement/CT016/725419/Abstract-CT016-Clinical-and-translational-findings
*200 https://pubmed.ncbi.nlm.nih.gov/35344029/
*201 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-erdafitinib-metastatic-urothelial-carcinoma
*202 https://www.jnj.com/media-center/press-releases/balversa-erdafitinib-receives-u-s-fda-approval-for-the-treatment-of-patients-with-locally-advanced-or-metastatic-urothelial-carcinoma-with-certain-fgfr-genetic-alterations
*203 NEJM 2019 https://www.nejm.org/doi/full/10.1056/nejmoa1817323
*204 JTO Clin res rep 2023. https://www.jtocrr.org/article/S2666-3643(23)00050-4/fulltext
*205 https://www.annalsofoncology.org/article/S0923-7534(22)00110-7/fulltext
*206 Gynecol Oncol Rep. 2022 https://pubmed.ncbi.nlm.nih.gov/35586703/
*207 BMC Gastroenterol 2022 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9331120/
*208 Cancer Discov. 2016 https://pubmed.ncbi.nlm.nih.gov/27179038/
*209 https://ascopost.com/news/november-2020/futibatinib-for-patients-with-refractory-intrahepatic-cholangiocarcinoma-and-fgfr2-fusionsrearrangements/
*210 https://rctportal.niph.go.jp/en/detail?trial_id=jRCT2031210043
*211 https://ascopubs.org/doi/10.1200/PO.18.00100
*212 Mol Onc 2024 https://febs.onlinelibrary.wiley.com/doi/10.1002/1878-0261.13597
*213 Target Oncol 2020 https://pubmed.ncbi.nlm.nih.gov/33068284/
*214 Cancer Sci 2021 https://pubmed.ncbi.nlm.nih.gov/33075166/
*215 JCO 2022 https://pubmed.ncbi.nlm.nih.gov/35349331/
*216 JAMA 2014 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4249701/
*217 JCO 2017 https://ascopubs.org/doi/10.1200/JCO.2017.74.1090
*218 https://ascopubs.org/doi/full/10.1200/JCO.20.02903
*219 悪性神経膠腫治療の最近のエビデンス 2013 https://www.ncc.go.jp/jp/ri/division/brain_tumor_translational_research/project/020/20170907102931.html
*220 http://ganpro.med.kyoto-u.ac.jp/wp-content/uploads/2018/02/mm116_201312.pdf
*221 Lancet Oncol 2020. https://doi.org/10.1016/S1470-2045(20)30157-1
*222 JAMA oncol 2021 https://jamanetwork.com/journals/jamaoncology/fullarticle/2784216
*223 NEJM 2022 https://www.nejm.org/doi/full/10.1056/NEJMoa2117344
*224 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ivosidenib-first-line-treatment-aml-idh1-mutation
*225 https://www.mycancergenome.org/content/gene/jak1/
*226 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5679612/
*227 https://cancerdiscovery.aacrjournals.org/content/7/2/188
*228 https://ashpublications.org/blood/article-abstract/doi/10.1182/blood.2021013379/477331/Phase-II-biomarker-driven-study-of-ruxolitinib?redirectedFrom=fulltext
*229 https://www.gilead.com/news-and-press/press-room/press-releases/2020/8/gilead-receives-complete-response-letter-for-filgotinib-for-the-treatment-of-moderately-to-severely-active-rheumatoid-arthritis
*230 JTO 2021 https://www.jto.org/article/S1556-0864(21)03284-6/pdf
*231 J Immunotherap oncology 2022. https://jitc.bmj.com/content/10/2/e003027
*232 https://pubmed.ncbi.nlm.nih.gov/26424760/
*233 Cancer Chemother Pharmacol 2011 https://pubmed.ncbi.nlm.nih.gov/21116624/
*234 JCO 2013 https://pubmed.ncbi.nlm.nih.gov/23775962/
*235 https://www.onclive.com/view/fda-grants-breakthrough-therapy-designation-to-adagrasib-for-kras-g12c-mutated-nsclc
*236 ASCO GI 2022 https://dailynews.ascopubs.org/do/10.1200/ADN.22.200802/full/
*237 https://meetings.asco.org/abstracts-presentations/229373
*238 Nat Med 2022 https://www.nature.com/articles/s41591-022-02007-7
*239 NEJM 2022 https://www.nejm.org/doi/full/10.1056/NEJMoa2119662
*240 NEJM 2016 https://www.nejm.org/doi/10.1056/NEJMoa1609279
*241 https://medical.nikkeibp.co.jp/leaf/mem/pub/search/cancer/news/202104/569866.html
*242 JNCCN 2022 https://jnccn.org/view/journals/jnccn/aop/article-10.6004-jnccn.2022.7001/article-10.6004-jnccn.2022.7001.xml
*243 JCO 2022 https://pubmed.ncbi.nlm.nih.gov/35353553/
*244 JCO 2022 https://pubmed.ncbi.nlm.nih.gov/35363510/
*245 https://ascopubs.org/doi/abs/10.1200/JCO.2020.38.4_suppl.180
*246 Front Oncol https://pubmed.ncbi.nlm.nih.gov/32766143/
*247 https://pubmed.ncbi.nlm.nih.gov/18632602/
*248 https://pubmed.ncbi.nlm.nih.gov/26582713/
*249 JCO 2015 4099-4105 https://ascopubs.org/doi/abs/10.1200/jco.2015.62.4726
*250 Cancer Discov 2019 https://pubmed.ncbi.nlm.nih.gov/31227518/
*251 PNAS 2009 https://www.pnas.org/doi/full/10.1073/pnas.0905833106
*252 https://www.cosmobio.co.jp/product/detail/cytoskeleton_news_201707.asp?entry_id=33316
*253 https://jrct.niph.go.jp/latest-detail/jRCT2031220405
*254 Clin Cancer Res 2023 https://aacrjournals.org/clincancerres/article/doi/10.1158/1078-0432.CCR-22-3629/725715/Impact-of-Biomarker-Matched-Therapies-on-Outcomes
*255 https://www.haigan.gr.jp/modules/important/index.php?content_id=227
*256 https://www.jto.org/article/S1556-0864(18)31258-9/fulltext
*257 https://upload.umin.ac.jp/cgi-open-bin/ctr/ctr_view.cgi?recptno=R000035817
*258 https://www.ncbi.nlm.nih.gov/pubmed/27666659
*259 https://medical.nikkeibp.co.jp/leaf/mem/pub/search/cancer/news/202005/565443.html
*260 https://medical.nikkeibp.co.jp/leaf/mem/pub/search/cancer/news/202004/565331.html
*261 https://www.novartis.co.jp/news/media-releases/prkk20200629-4
*262 https://www.chugai-pharm.co.jp/news/detail/20200529150002_980.html
*263 https://pubmed.ncbi.nlm.nih.gov/2893683/
*264 https://medical.nikkeibp.co.jp/leaf/mem/pub/search/cancer/news/202003/564909.html
*265 NEJM 2020 https://www.nejm.org/doi/full/10.1056/nejmoa2002787
*266 Ann Oncol 2020 https://www.annalsofoncology.org/article/S0923-7534(20)36380-8/fulltext
*267 Br J Cancer 2019 https://www.nature.com/articles/s41416-019-0573-8
*268 J Thorac Oncol 2020 https://pubmed.ncbi.nlm.nih.gov/31864549/
*269 https://pubmed.ncbi.nlm.nih.gov/27664533/
*270 https://ascopubs.org/doi/10.1200/JCO.2018.36.15_suppl.9062
*271 http://www.scrum-japan.ncc.go.jp/lc_scrum/trial/crizotinib_b/index.html
*272 https://www.ncc.go.jp/jp/ncce/division/clinical_trial/patient/colon/20190122094651.html
*273 Lung Cancer 2019 https://pubmed.ncbi.nlm.nih.gov/30885356/
*274 Cancer Discov 2015 https://cancerdiscovery.aacrjournals.org/content/5/8/850
*275 JCO 2016 https://ascopubs.org/doi/pdf/10.1200/JCO.2015.63.4600
*276 http://www.jsccr.jp/guideline/2016/hereditary_particular.html#no2
*277 Journal of the National Cancer Institute: Vol.99: p291-299, 2007
*278 American Journal of Human Genetics: Vol.72(5): p1088-1100, 2003
*279 Cancer Letters: Vol.248(1): p89-95, 2007
*280 https://mgend.med.kyoto-u.ac.jp/variant/info/INSERTION|hg19|chr2%3A48033984-48033984|g%3EGATT
*281 Fam Cancer 2004 101-107
*282 遺伝性大腸癌診療ガイドライン2016年版 p.44,p.49
*283 Gastroenterol 2008 419-428.
*284 Eur J Cancer 2009 1890-1896.
*285 BMC Cancer 2015 156.
*286 J Clin Oncol 2015 4176-4187.
*287 Cancer Res 2003 5738-5744
*288 Lancet 2011 2081-2087.
*289 Genetics in Medicine: Vol.11(1): p42-65, 2009
*290 Hum Mutat 2013 490-497.
*291 NCCN guideline. genetic/familial high-risk assessment: colorectal 2015
*292 https://www.cell.com/cancer-cell/fulltext/S1535-6108(15)00336-0
*293 https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-022-03436-1
*294 nat commun 2022 https://www.nature.com/articles/s41467-022-30916-1
*295 JCOPO 2024 https://ascopubs.org/doi/full/10.1200/PO.23.00251
*296 Cancer Discov https://aacrjournals.org/cancerdiscovery/article-abstract/13/1/4/712675/Direct-MYC-Inhibitor-Passes-First-Clinical
*297 https://bmccancer.biomedcentral.com/articles/10.1186/s12885-019-6442-2
*298 JCO PO https://ascopubs.org/doi/full/10.1200/PO.18.00028
*299 https://www.jcga-scc.jp/ja/gene/NFE2L2
*300 JTO 2022. https://www.jto.org/article/S1556-0864(22)01825-1/fulltext
*301 JCOPO 2023 https://ascopubs.org/doi/abs/10.1200/PO.22.00666
*302 Cancer Discov https://aacrjournals.org/cancerdiscovery/article/doi/10.1158/2159-8290.CD-23-1138/734318/Sotorasib-Is-a-Pan-RASG12C-Inhibitor-Capable-of
*303 eur j cancer 2024 https://www.ejcancer.com/article/S0959-8049(24)00164-3/abstract
*304 Lancet Oncol 2017 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(17)30180-8/fulltext
*305 eur j cancer 2024 https://www.ejcancer.com/article/S0959-8049(24)00164-3/abstract
*306 Clin Cancer Res 2019 https://aacrjournals.org/clincancerres/article/25/16/4966/124940/Detection-of-NRG1-Gene-Fusions-in-Solid-TumorsNRG1
*307 Cancer Discov 2018 https://pubmed.ncbi.nlm.nih.gov/29802158/
*308 https://www.onclive.com/view/zenocutuzumab-wins-fda-breakthrough-therapy-designation-for-advanced-nrg1-nsclc
*309 Nat Commun https://www.nature.com/articles/s41467-021-21396-w
*310 https://ascopubs.org/doi/full/10.1200/PO.18.00183
*311 https://journals.lww.com/ajsp/Abstract/2017/11000/Pan_Trk_Immunohistochemistry_Is_an_Efficient_and.13.aspx
*312 https://oncologypro.esmo.org/oncology-in-practice/anti-cancer-agents-and-biological-therapy/targeting-ntrk-gene-fusions/overview-of-cancers-with-ntrk-gene-fusion/trk-inhibitors/acquired-resistance-to-trk-inhibitors
*313 Nat Rev Clin Oncol 2018. https://pubmed.ncbi.nlm.nih.gov/30333516/
*314 Cancer Discov 2018. https://pubmed.ncbi.nlm.nih.gov/26546295/
*315 AACR2019学会抄録 https://cancerres.aacrjournals.org/content/79/13_Supplement/LB-118
*316 Oncologist 2020 https://pubmed.ncbi.nlm.nih.gov/32323889/
*317 N Engl J Med 363:24-35, 2010
*318 https://www.ncbi.nlm.nih.gov/pubmed/25267748
*319 https://products.sysmex.co.jp/products/genetic/AK401170/OncoGuideNCC.pdf
*320 NEJM 2020 https://www.nejm.org/doi/10.1056/NEJMoa1911440
*321 https://ascopubs.org/doi/abs/10.1200/JCO.21.00003
*322 Mol Clin Oncol 2020 https://www.spandidos-publications.com/10.3892/mco.2020.2168
*323 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4809439/
*324 https://pubmed.ncbi.nlm.nih.gov/26130666/
*325 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5137998/
*326 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6145709/
*327 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(20)30269-2/fulltext
*328 https://www.annalsofoncology.org/article/S0923-7534(20)34036-9/fulltext
*329 Sci Rep 2020 https://www.nature.com/articles/s41598-020-74086-w
*330 iScience 2023 https://www.cell.com/iscience/fulltext/S2589-0042(23)01182-3
*331 Proc Natl Acad Sci 107 : 10208-10213, 2010
*332 Lancet Oncol 2015 1324-1334
*333 BrJ Cancer 2017 726-730
*334 https://cslide.ctimeetingtech.com/esmo2020/attendee/confcal/session/calendar/2020-09-19
*335 https://clinicaltrials.gov/ct2/show/NCT04251533
*336 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-capivasertib-fulvestrant-breast-cancer
*337 https://pubmed.ncbi.nlm.nih.gov/31859350/
*338 https://www.ascopost.com/issues/july-25-2020/double-pik3ca-mutations-and-response-benefit-in-breast-cancer/
*339 https://www.onclive.com/view/dr-soliman-on-the-rationale-for-using-immunotherapy-in-tnbc
*340 https://science.sciencemag.org/content/366/6466/714.editor-summary
*341 JAMA Oncol 2019. https://jamanetwork.com/journals/jamaoncology/fullarticle/2748391
*342 https://pubmed.ncbi.nlm.nih.gov/31475851/
*343 clin cancer res https://clincancerres.aacrjournals.org/content/early/2021/04/01/1078-0432.CCR-21-0163
*344 J Clin Invest 2016. https://www.ncbi.nlm.nih.gov/pubmed/27159395
*345 Genome Med 2023 https://genomemedicine.biomedcentral.com/articles/10.1186/s13073-023-01234-y
*346 https://www.mycancergenome.org/content/alteration/pole-p286r/
*347 https://www.mycancergenome.org/content/alteration/pole-v411l/
*348 Ann Oncol https://www.annalsofoncology.org/article/S0923-7534(20)38437-4/fulltext
*349 Nat Commun https://www.nature.com/articles/s41467-018-08114-9
*350 Oncotarget https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5356579/
*351 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7955730/
*352 Fam Cancer 2015. https://pubmed.ncbi.nlm.nih.gov/25860647/
*353 https://mgen.ncgm.go.jp/disease/68/variants
*354 Nature 2012. https://www.ncbi.nlm.nih.gov/pubmed/22810696
*355 Cell 2017, 1042–1056. https://pubmed.ncbi.nlm.nih.gov/29056344/
*356 Clin Cancer Res 2018. http://clincancerres.aacrjournals.org/content/clincanres/early/2018/07/21/1078-0432.CCR-18-0981.full.pdf
*357 Clin Cancer Res 2020 https://pubmed.ncbi.nlm.nih.gov/32019858/
*358 https://pubmed.ncbi.nlm.nih.gov/31018950/
*359 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-capivasertib-fulvestrant-breast-cancer
*360 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(17)30450-3/fulltext
*361 https://clinicaltrials.gov/ct2/show/NCT03337724
*362 Science, 1999 212-2125
*363 JCOPO 2018 https://ascopubs.org/doi/full/10.1200/PO.18.00253
*364 https://cdrjournal.com/article/view/3171
*365 https://clinicaltrials.gov/ct2/show/NCT02693535
*366 https://www.nature.com/articles/s41586-019-1012-y
*367 解説記事 ケアネット https://www.carenet.com/news/general/carenet/48906
*368 Lancet Oncol 2022 https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045%2822%2900541-1/fulltext
*369 NEJM 2020 https://www.nejm.org/doi/full/10.1056/nejmoa2005651
*370 Lancet Diabet Endocrinol 2021 https://www.thelancet.com/journals/landia/article/PIIS2213-8587(21)00120-0/fulltext
*371 NEJM 2020 https://www.nejm.org/doi/full/10.1056/nejmoa2005651
*372 NEJM 2023 https://www.nejm.org/doi/full/10.1056/NEJMoa2309719
*373 NEJM 2020 https://www.nejm.org/doi/10.1056/nejmoa2005651
*374 NEJM 2020. https://www.nejm.org/doi/full/10.1056/NEJMoa2005653
*375 https://medical.nikkeibp.co.jp/inc/mem/pub/search/cancer/news/202109/572136.html
*376 https://news.lilly.co.jp/PDFFiles/2022/22-05%20co.jp.pdf
*377 https://pubmed.ncbi.nlm.nih.gov/31710864/
*378 https://ascopubs.org/doi/10.1200/JCO.2016.34.15_suppl.9013
*379 https://pubmed.ncbi.nlm.nih.gov/25349307/
*380 https://pubmed.ncbi.nlm.nih.gov/23533264/
*381 JCOPO 2019 https://ascopubs.org/doi/pdf/10.1200/PO.19.00189
*382 JNCCN https://jnccn.org/view/journals/jnccn/20/9/article-p966.xml
*383 http://men-net.org/medical/inspection.html
*384 http://www.noguchi-med.or.jp/test/gene/men2
*385 Revised American Thyroid Association Guidelines for the management of medullary thyroid carcinoma. Thyroid 25: 567-610, 2015
*386 https://www.jfcr.or.jp/laboratory/news/8217.html
*387 https://www.nature.com/articles/s41467-021-21396-w
*388 https://www.thermofisher.com/jp/ja/home/about-us/news-gallery/release/2020/pr082120.html
*389 https://www.chugai-pharm.co.jp/news/detail/20191226113000_924.html
*390 Clin Cancer Res 2020 https://clincancerres.aacrjournals.org/content/26/21/5701 https://pubmed.ncbi.nlm.nih.gov/32709715/
*391 JTO 2020 https://www.jto.org/article/S1556-0864(20)30295-1/fulltext
*392 Ann Oncol 2018 https://www.annalsofoncology.org/article/S0923-7534(19)50077-1/fulltext
*393 Clin Cancer Res 2016 PMID 26671993
*394 https://pubmed.ncbi.nlm.nih.gov/25103190/
*395 Mol Oncol PMID 33107184
*396 https://pubmed.ncbi.nlm.nih.gov/30718506/
*397 Lancet Oncol 2020 https://pubmed.ncbi.nlm.nih.gov/33035459/
*398 https://www.ncbi.nlm.nih.gov/pubmed/19340305/
*399 Oncogene, vol. 29, no. 11, pp. 1588–1597, 2010. 他
*400 Cancer Discov 2018 https://cancerdiscovery.aacrjournals.org/content/8/7/822
*401 Cancer Cell 2018 https://www.ncbi.nlm.nih.gov/pubmed/29657128/
*402 https://ascopubs.org/doi/abs/10.1200/JCO.2019.37.15_suppl.102
*403 JTO 2021 https://www.jto.org/article/S1556-0864(21)03284-6/pdf
*404 http://grj.umin.jp/grj/pjs.htm
*405 胃と腸 35巻3号 2000 https://webview.isho.jp/journal/detail/abs/10.11477/mf.1403104810
*406 https://www.jmedj.co.jp/premium/treatment/2017/d050319/
*407 Nat Genet 2014 https://pubmed.ncbi.nlm.nih.gov/25362482/
*408 https://www.mdpi.com/2072-6694/12/8/2115
*409 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7086299/#s11title
*410 https://meetings.asco.org/abstracts-presentations/207594
*411 https://medical.nikkeibp.co.jp/leaf/all/cancernavi/news/202403/583658.html
*412 https://ascopubs.org/doi/full/10.1200/JCO.2016.71.9096
*413 JNCI 2018 https://www.ncbi.nlm.nih.gov/pubmed/29529297/
*414 JNCI 2018 https://www.ncbi.nlm.nih.gov/pubmed/29529278
*415 http://www.falco-genetics.com/gene_analysis/tumor_gene/li-fraumeni.html
*416 Radio―induced alignancies after breast cancer postoperative radiotherapy in patients with Li―Fraumeni syndrome. Radiat Oncol. 2010;5:104. PMID:21059199
*417 http://jbcs.gr.jp/guidline/2018/index/housyasen/h01/
*418 Cancer Discov 2013 https://pubmed.ncbi.nlm.nih.gov/23103855/
*419 https://medical.nikkeibp.co.jp/leaf/all/gakkai/asco2007/200706/503399.html
*420 NEJM 2021 https://www.nejm.org/doi/full/10.1056/NEJMoa2103425
*421 https://www.nature.com/articles/s41375-018-0017-0
*422 https://www.nature.com/articles/s41375-018-0017-0
*423 ASCO 2018 https://ascopubs.org/doi/10.1200/JCO.2018.36.15_suppl.5545
*424 https://www.targetedonc.com/view/fda-grants-pembrolizumab-priority-review-for-tmbhigh-tumors
*425 https://oncologypro.esmo.org/meeting-resources/esmo-2019-congress/Association-between-tissue-TMB-tTMB-and-clinical-outcomes-with-pembrolizumab-monotherapy-pembro-in-PD-L1-positive-advanced-NSCLC-in-the-KEYNOTE-010-and-042-trials
*426 ESMO news 2019 https://www.esmo.org/oncology-news/tTMB-Is-Not-Established-as-a-Marker-for-Pembrolizumab-Efficacy-in-NSCLC
*427 https://meetinglibrary.asco.org/record/185416/abstract
*428 Cancer Cell 2021 https://www.cell.com/cancer-cell/fulltext/S1535-6108(21)00213-0
*429 https://chugai-pharm.jp/content/dam/chugai/product/f1t/cdx/specimen/doc/F1CDx_specimen.pdf
*430 https://www.foundationmedicine.in/content/dam/rfm/in_v2-en_in/CDx/FOneCDx%20Tech%20Info.pdf
*431 https://www.pathology.or.jp/news/20231218_guidance20221228.pdf
更新日:2024-04-06 閲覧数:17480 views.