FoundationOne CDxのBRCAコンパニオン検査承認はパネル検査のタイミングを変えるか
前立腺がんの BRCA検査をFoundationOne CDxをコンパニオン診断薬として行った際の診療報酬が20,200点と定められました。これは、BRACAnalysisでgermline BRCAの検査を行う場合の保険点数と同じ点数になっています。somaticとgermlineの違いはありますが、それについては別のページで詳しく言及しているのでそちらをご覧ください。

さて、この保険点数が8,000点よりも大きな20,200点と設定されたことはかなり大きな意味がありそうです。「8,000点より大きな20,200点」というのはどういう意味か。
これまでコンパニオン診断としては事実上使えなかった
現在、がん遺伝子パネル検査を保険診療で行う場合は「包括的なゲノムプロファイル」としてと「コンパニオン検査」として行うことができます。前者は標準治療終了後という大きな検査タイミングの制約が付いている代わりに8,000点+48,000点で合計56,000点の診療報酬となっているのに対して、FoundationOne CDxの2つ目の使用目的であるコンパニオン検査として使用する場合は(標準治療終了後という縛りが付かない代わりに)極めて少ない保険点数しか付かないのです。
標準治療前にコンパニオン検査として実施した際にも、将来的に標準治療が終了した後に、事前に実施していたコンパニオン検査時に取得した包括的がゲノムプロファイルをもとにエキスパートパネルを開催して結果を説明すればその時点で48,000点を算定できます。しかし検査費用は事前に支払っているため、この48,000点部分が医療機関にとって「売掛金」になり、ましてや他疾患(たとえば心筋梗塞や交通事故)で休止した場合にはその48,000点部分が回収できなくなるので、少しハードルが高いのです。
あと「中医協総-1元.5.29」の15ページの(イ)が(極めて難解な文書ですが)、コンパニオン診断の際に取得した包括的ゲノムプロファイルを標準治療終了後にエキスパートパネルにかけて患者に説明した場合にも算定して良い、ということを言っているのだと思います(多分…)。https://t.co/TBPOAIdEzL
— レ点.bot💉💊🧬 (@m0370) January 9, 2021
非小細胞肺癌の場合はオンコマインDxを使えるのでこのことで頭を悩ます必要はあまりないのですが、乳癌・大腸癌・悪性黒色腫にはFoundationOne CDxとしてコンパニオン診断としての承認を取っていても点数は2,100〜6,520点しか点数が付いていません。検査会社に支払う検査費用は両者同額(40〜45万円程度+消費税)であるため、実際は保険点数の関係でコンパニオン検査として使うことはできず、標準治療終了後の「包括的なゲノムプロファイル」としてしか実施できないのが実情です。
- 医療機器の保険適用について(令和元年6月収載予定)中医協 総-1 元.5.29
https://www.mhlw.go.jp/content/12404000/000513115.pdf
- モダンメディア 65巻12号2019 臨床検査アップデート「がん遺伝子パネル検査 保険収載の概要と課題」
https://www.eiken.co.jp/uploads/modern_media/literature/2019_12/003.pdf
このような保険点数の付け方は非常に理解に苦しむものだということで本来のがんゲノム医療の強みが生かせないという声が上がり、学会などでも問題視されました。2019年の日本臨床腫瘍学会(国立京都国際会館)ではがん遺伝子パネル検査関連のシンポジウムが多数開催されましたが、初日(2019年7月18日)のASCO/JSMO合同シンポジウム「Precision Oncology: How Do We Use a Panel Gene Test?」でも翌日の日本癌学会/日本癌治療学会/日本臨床腫瘍学会の3学会合同シンポジウム「がんゲノム医療の臨床実装」でも、この保険点数の付け方に疑問を投げかける声が多数聞かれました。
今回BRCA検査に点数が付いた意味
さて、ここからがようやく今回の本題です。2020年12月の前立腺癌に対するFoundationOne CDxのBRCA検査としてのコンパニオン診断機能の保険承認では20,200点の保険点数が付きました。この点数が20,200点(>8,000点)という点数に設定されたのは大きな意味がありそうです。8,000点より大きなコンパニオン検査としての点数が設定されたということは、FoundationOne CDxの実施にコンパニオン検査としての使用症例数が一気に弾みが付くからです。
前立腺癌においても、これまでは標準治療終了後にしかFoundationOne CDxを行うことは(ほとんど)ありませんでした。しかし、今後は転移性mCRPCとなった時点で標準治療が終了する前に速やかにコンパニオン検査(20,200点)としてFoundationOne CDxを行うケースが増えそうです。ここの時点でBRCA変異を評価し、somaticであれgermlineであれBRCA変異が陽性であればオラパリブを、陰性でかつ新規ホルモン薬(エンザルタミドまたはアビラテロンのいずれか)が未使用であればこれを用います。そしてオラパリブまたは新規ホルモン薬を使用開始した後のしかるべきタイミングで「標準治療終了見込み」としてエキスパートパネルを開催し、この結果を患者に説明します(48,000点)。
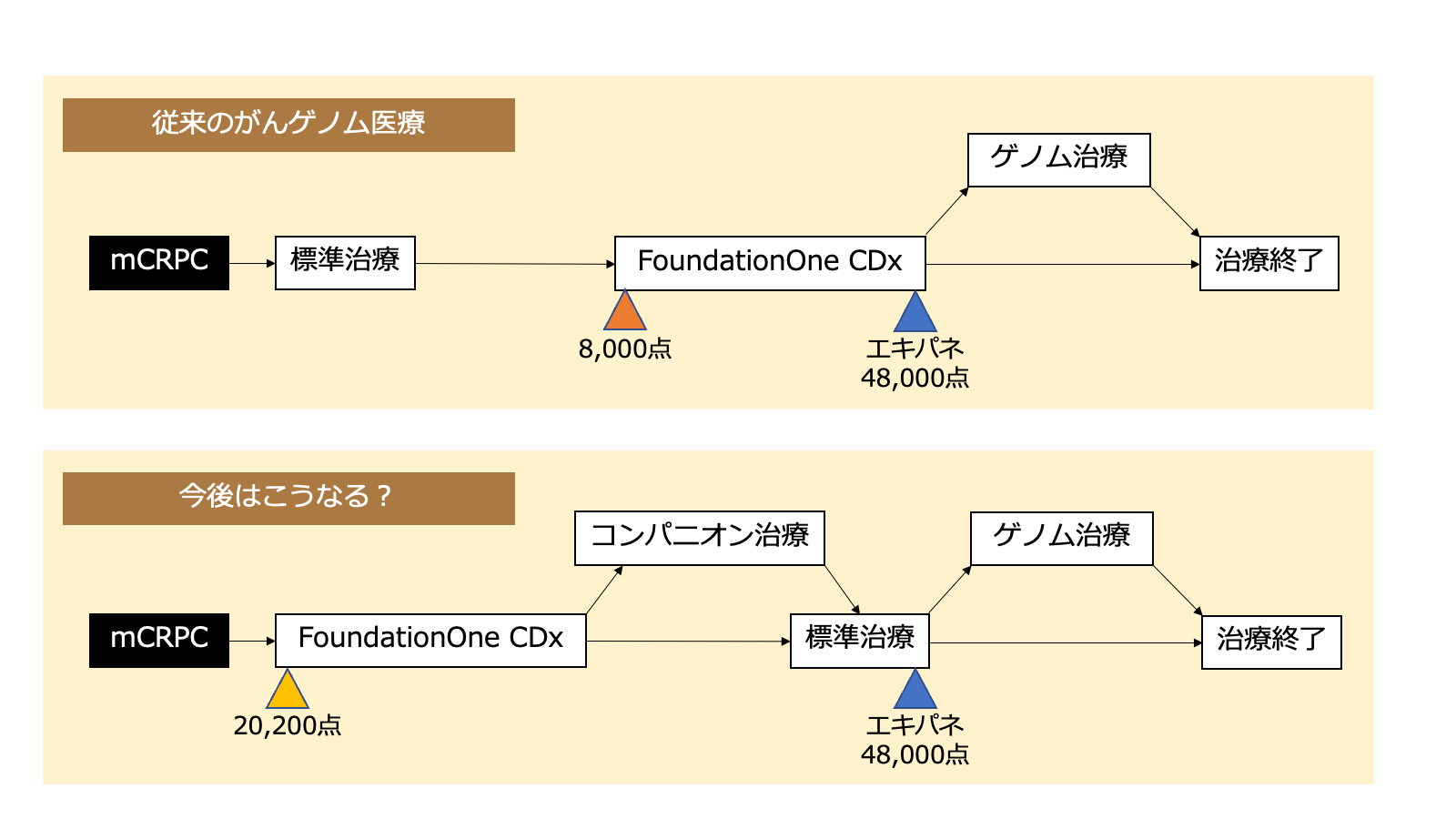
この流れによって、標準治療終了後にFoundationOne CDxを行えば合計56,000点であったところが、転移性mCRPCの標準治療開始前にFoundationOne CDxを行えば合計68,200点に増えることになるわけです。検査会社に支払うコストは同等ですので、コンパニオン検査を行う意義が高い臓器の腫瘍ではFoundationOne CDxを使うインセンティブを高めることができます。
もちろんこのようになっても68,200点のうち48,000点の部分が「売掛金」であることにはかわらないのですが、前立腺癌がmCRPCになってからエンザルタミド(またはアビラテロン)に抵抗性となるまでの期間に限られる売掛金なのでそこまで懸念する問題にはなりにくそうな印象です。
優れたコンパニオン診断には適切な処遇が
2018年にはじめにパネル検査の8000→48000点を聞いた時は「アホか!逆に48000→8000にしろよ!」と思ったけど、20200→48000のルートへ拡張可能なことなどを考えると8000→48000という配分はよくできてるなぁと感心した。初めからこうなることを想定しての8000→48000点だったのだろうか。。
— レ点.bot💉💊🧬 (@m0370) January 9, 2021
つまり、現行の包括的ゲノムプロファイルとしての検査はエビデンスが乏しいので保険点数は抑えめにし、なおかつ予後が不良な症例に対しては検査が乱発されないように検査の最終結果が出るまで保険償還が受けられないようにして過剰検査を牽制します。一方で、今回のBRCA変異前立腺癌のように適切なバイオマーカーがある癌腫で、なおかつ今後の治療継続も期待できるPSも良好な症例なら積極的にがんゲノム医療を推進できるようにします。8,000点より少し高い絶妙なコンパニオン診断料を付加することで、合計56,000点よりちょっと色をつけたゲノム医療点数に導ける。非常にうまく設計されているように思います。賢いなぁ。今まで文句言ってごめんなさいって感じ。
今までは合計56,000点という保険点数ではがん遺伝子パネル検査をやればやるほど経営的には医療機関に負担がかかり、やるだけ損という印象もありました。しかしコンパニオン検査の意義が大きい前立腺癌のような臓器に限って8,000点の部分に代わりに20,200点のコンパニオン検査としての適応を当てはめることで合計が56,000点ではなく68,200点となり、ゲノム診療を根付かせたい癌腫とそうでない癌腫で、同じ検査をしてるのに点数を微妙に差異化することで、がんゲノム医療を少しずつですが理想的な方向に誘導できる可能性があるということになります。
今後も他の臓器で、8,000点よりは微妙に高いコンパニオン検査点数を設定する癌腫が増えてくるでしょう。また今はオンコマインDxが主流になっている非小細胞肺癌の多遺伝子検査にこの考え方を導入しようとすれば、オンコマインDxで設定されている複数バイオマーカー一括検査の11,700点がFoundationOne CDxのコンパニオン診断機能に準用されるのでしょうか?(コンパニオン診断薬のグループ化の流れにも影響されますが、今後の分子標的治療もFoundationOne CDxがコンパニオン診断として利用されているものが大多数ですしFoundationOne CDx以外のパネル検査がFoundationOne CDxと同じペースでエビデンスを出してゆくのは到底現実的ではないので、非小細胞肺癌も徐々にこの流れに取り込まれてゆくように思います)。
コンパニオン検査として行う場合はTMB・MSIの結果報告の違いに注意
なお、FoundationOne CDxをコンパニオン検査として行った場合にはTMB・MSIおよび二次的所見の判断根拠となる生殖細胞系列遺伝子変異については「CDxの場合は結果を公表しない」ということになっています。
また、「包括的なゲノムプロファイル」としてFoundationOne CDxを行った場合にはいわゆる「2ページ目」以外のページに記載される情報についてもどうなるかわかりません(FoundationOne CDxが承認を得ているのはレポートのいわゆる「2ページ目」に記載される部分のみで、その他のページに記載される内容は承認を受けていない「未承認の追加情報」という扱いになっています)。したがって、いわゆる「2ページ目」以外の情報はFoundationOne CDxを「包括的なゲノムプロファイル」ではなく「コンパニオン検査」として実施した場合にどういう記載になるのか(あるいは全く記載されないのか)は確認が必要です(ぼくはまだ把握できていません)。
そういえびこないだ聞いた話で1番驚いたのが、foundationone cdx の添付文書要件は結果が載ってる2ページ目のみで、あとはすべてprofessional service が付いてるだけってこと。
— vitzie (@vitzie) October 10, 2020
なので、以後のページは保険診療としての内容の縛りを受けてない。
それから生殖細胞系列遺伝子変異については、今でも「包括的なゲノムプロファイル」としてFoundationOne CDxを行った場合には特に情報はついていないですよね。だからこれはあまり変わりなさそうです。
また、リキッドバイオプシーで近々承認されると言われるFoundationOne Liquid CDxが同じコンパニオン診断機能の承認を備えているのか、点数はどうなるのか(検体採取からライブラリ調整までの手間や必要試薬・人件費が大幅に少ないので点数がいくらか削られる可能性はあるのではないかと思っています)。これも気になるところです。
エキパネを行うタイミング(特にがんゲノム医療連携病院)
ここまで見てきたように、コンパニオン診断としてのFoundationOne CDxの使用用途が普及し、それをEBM的にも妥当な診療でありながら経営的にも持続可能な状態に保つためには、これまで以上に「コンパニオン検査として実施するタイミング」と「標準治療終了後の包括的がゲノムプロファイル検査としてエキスパートパネルを開催して結果を説明するタイミング」が重要になります。
mCRPCに対するFoundationOne CDxは上記のように比較的分かりやすい上にそもそも前立腺癌の進行は比較的緩除なのでタイミングをはかりやすいのですが、標準治療自体が長い乳癌、標準治療が終了した後では多発転移などにより全身治療がすでに悪化していることが少なくない肺癌・大腸癌・膵癌では、コンパニオン検査としてのFoundationOne CDxを実施した後にエキスパートパネルを行う最適なタイミングの見極めが難しいかも知れません。
となると、エキスパートパネルを自施設でタイミングで開催できる「がんゲノム医療中核拠点病院」や「がんゲノム医療拠点病院」に比べて、自施設単独では好きなタイミングでエキスパートパネルを開催できない「がんゲノム医療連携病院」は、がん遺伝子パネル検査の最高のパフォーマンスを引き出す上の足かせが多くなります。今までは患者申出療養以外にはがんゲノム医療連携病院でも特に大きな不自由を感じることが少なかったのが実感(むしろ拠点病院になってしまうと業務量が増えてしまって大変なのでデメリットが強かった)ですが、今後は「がんゲノム医療連携病院」が「がんゲノム医療拠点病院」への昇格を目指す動きが強まるでしょう。
今後の方向性はまだ見通し立たず不明確
内保連の「2022年度改訂提案書提出状況」という文書を見るとFoundationOne CDxをコンパニオン診断として実施した場合は標準治療終了するまで48,000点部分の保険請求ができない事に関して修正の要望が出されているようです。なので48,000点部分が標準治療終了まで請求できないというひずみもいつまでも続くわけではなく、少しずつ是正されてゆく流れもありそうです。
FoundationOne CDxがんゲノムプロファイルは、コンパニオン診断とがんゲノムプロファイリング検査の両機能を有している。コンパニオン診断として薬事承認された癌腫において本品を標準治療前に使用する場合、その結果を医薬品の適応判定補助として使用可能である。一方、同時に得ている包括的ながんゲノムプロファイルの結果は、標準治療の終了(終了見込み含む)時にエキスパートパネルでの検討を経て結果及び治療方針等を患者に説明することとされている。そのため、当該検査を実施しても、「結果説明時」の保険請求ができず、検査会社への支払いと保険請求金額及びタイミングに差異が生じることから、利用困難な状況である。必要な患者が臨床試験により有用性が検証された医薬品への投与の機会を確保するため、標準治療の終了(終了見込み含む)時に限定せず「結果説明時」の保険請求を可能とする必要がある。

しかしこれにはまだまだ時間がかかりそうです。より早いラインでコンパニオン検査を行い最適な治療を提供するというのは世界的な流れではありますが、保険診療として行う限りは保険償還がどのように行われるかということに強い制約を受けます。今後も保険点数の付け方次第で実臨床の検査のタイミングも大きく変動しますが、しかし今回のFoundationOne CDxのBRCAコンパニオン検査の保険点数がようやく(複数の条件の組み合わせという縛りの中では)採算ラインを上回ってきたのは大きな流れの変化につながりそうです。
【注意】このフローでのエキスパートパネルを実施するかどうかは現時点では中核拠点病院に事前に確認してください(まだこのコンパニオン検査後のエキスパートパネルを受け入れ開始していない中核拠点病院もあるようです)。2021.1.23


がんゲノム FoundationOne BRCA コンパニオン検査
この記事に対するコメント
このページには、まだコメントはありません。
更新日:2021-01-10 閲覧数:5949 views.