検体のクロスコンタミネーション

がん遺伝子パネル検査検体のクロスコンタミネーションについて
2019年6月にがん遺伝子パネル検査が保険承認されてパネル検査の実施件数が増えるにつれて、その検査精度管理の問題が大きくなりつつあります。がんゲノム医療の精度に影響する因子は多岐にわたりますが、初期段階の大前提としてDNAのクロスコンタミネーションを起こさないという問題があります。がん遺伝子パネル検査に関連するクロスコンタミネーションについて勉強してみました。
国内のTOP-GEAR計画の報告では
国立がん研究センターのTOP-GEAR計画第2期の論文*1ではがん遺伝子パネル検査のコンタミネーション率について言及されています。
この文献ではクロスコンタミネーションの判定にContEstという方法を採用しているようです。ちょっと論文の中身は数式が出てきて素人にはよくわからないのですが、この方法で各症例のコンタミネーション率を推定する方法に使えるほか、臨床検査室全体の検査精度レベルの判定にも使えるようです。

国がんのTOP-GEAR計画第2段の論文では検体間のcross contaminationが9例(3.9%)となっていて、先日の癌学会2019のがんゲノム医療の品質精度管理のシンポでは、少なくともそのうち5例は病理部の切り出しの際に包丁やまな板を介して別患者のDNAが混入したと考察されてました。https://t.co/f1l22ZhtDh
— レ点.bot💉💊🧬 (@m0370) October 30, 2019
これによるとがん遺伝子パネル検査を実施した全体230例のうち9例でクロスコンタミネーションが疑われる結果があり、うち5例は他検体とのコンタミネーションが確認されたようです。2例ではDNA量(リード数)にして5%以上が混ざっているという結果だったようなので、これは包丁やまな板だけを介しているのか、他のもっと大きな組織切片などが混ざる要因があったのか…。
クロスコンタミネーションが起こっていた症例の特徴としてDNA品質が悪い検体や検体量が少ないケースが挙げられています。これは当然、DNAが非常に良質で多量にある場合はコンタミネーションDNAの割合を下げることができるのに対して検体が少ない場合はスライドをかき集める必要があるためでしょう。カバレッジ(本来読むべきDNAに由来するリード数)が低いと、コンタミネーションリード(混入したDNAに由来するリード数)の存在感が相対的に増します。
クロスコンタミネーションに焦点を当てた文献
もっと直接的にNGSを用いたがん遺伝子プロファイリング検査のクロスコンタミネーションに言及した文献としては次のようなものがあります。2015年と少し古いデータなのでFoundationOne CDxなどの商業ベースのNGSがんプロファイリング検査が普及する前の、大学や研究機関が臨床試験ベースでNGS検査を行っていた時期のものです。

ハプロタイプ解析やマイクロサテライトタンデムリピートの反復解析などの方法を用いて、そのDNAが本当に該当する癌患者由来のDNAであるかどうかを検証するという方法のようです。296例の検査から、DNAリード数5%以上のDNAクロスコンタミネーションが見られた症例は全症例の3%であったと報告されていて、前述のTOP-GEAR計画第2期とそう大きく変わらない値です。6例のクロスコンタミネーションのうち大部分にあたる5例は得られた検体DNA量が200ng以下とそもそも極めて少なかったことが問題としてあげられています。
DNAのクロスコンタミネーションが生じたのがどの場面によるかが追跡できたものとしては、組織からDNA抽出を行う段階でのコンタミネーションなどが疑われる例や検体採取直後の段階でのコンタミネーションが考えられる事例があった、などと考察されています。
floaterと呼ばれる、ある症例の組織検体から他の症例の組織検体へ鑷子やハサミなどを介して微小な病理固有組織検体が移動しそのまま組織ブロックに埋め込まれてしまう汚染物質は外科病理の世界ではこれまでも問題になったことがありました。崩れやすい組織を固定・灌流処置を行っている最中に組織カセットから脱落させてしまい他のカセットに迷入させてしまうことも想定されます。
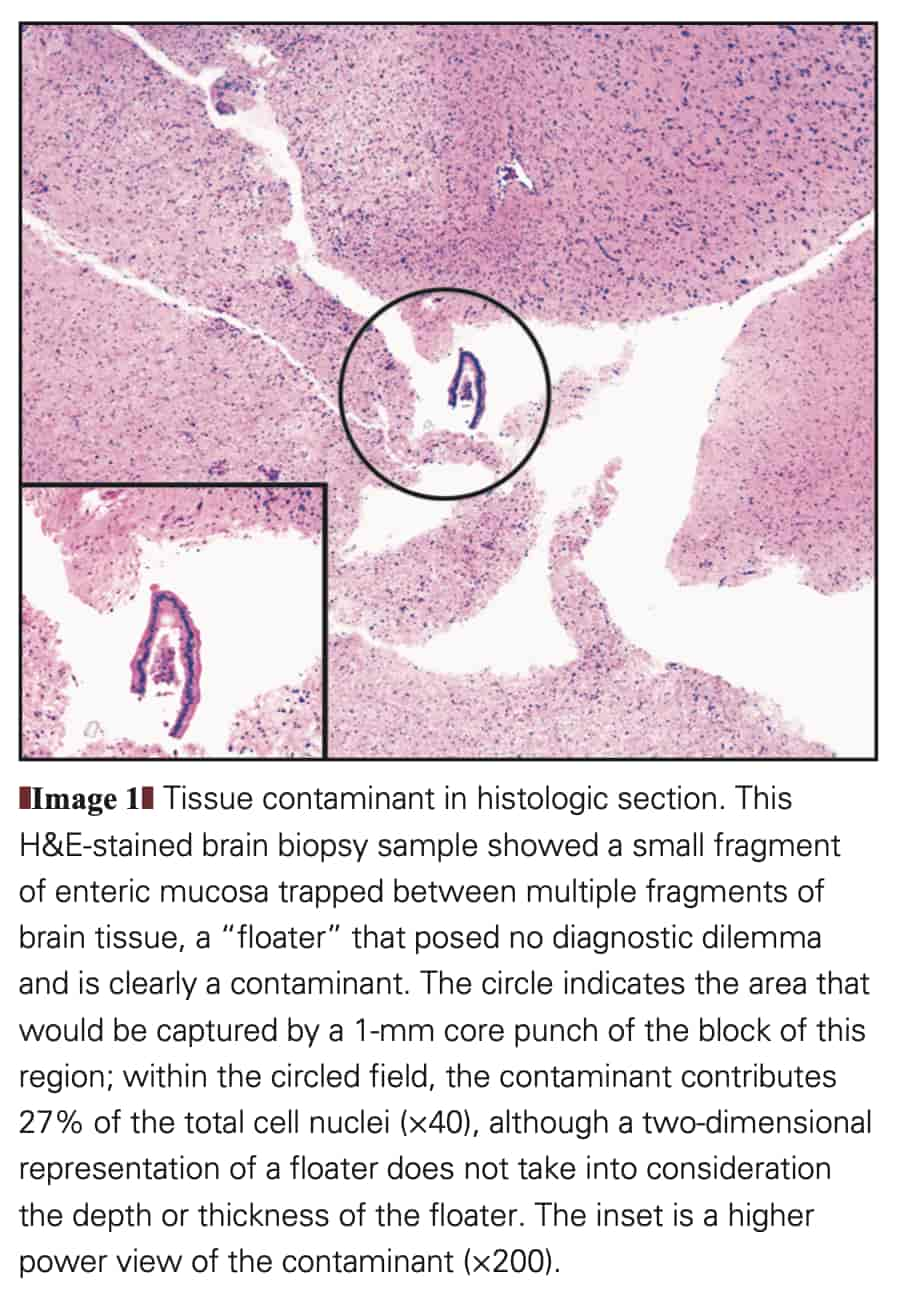
このような微小なfloaterはFigure 1のように見えることがありますが、微小であるが故に病理組織診断では病理専門医がコンタミネーションと判断して除外できます。DNAを抽出して行うがん遺伝子パネル検査ではそのような判断が働きにくいため、そのままクロスコンタミネーションとして問題化し得るのです。マイクロダイセクションなどの過程を経た検体ならこのような微小な混入が増幅されるので、なおさら大きな問題となります。

また、非常に低いVAF値で検出されたホットスポット変異はそれ自体がコンタミネーションなのかどうかという判定自体が困難です。本研究はDNAリード数にして5%という基準をコンタミネーションありと判定する閾値として用いていますが、これが臨床検査として妥当なのかどうかは今のところ検証不可能です。したがって、5%以下のリード数のものを含めれば実際のクロスコンタミネーションをきたした将来の割合はもっと高い値になる可能性もありそうです。
この文献はNGSを用いたがん遺伝子プロファイリング検査のコンタミネーションを考える上で非常に重要なことを示唆していると思います。結語段落の一文「Human-human specimen contamination occurs in clinical NGS testing.」、つまり臨床的NGS検査ではコンタミネーションは起こるものであるという一文が印象的です。ヒューマンエラーと同じで完全のゼロにすることは容易でないため、ある程度はクロスコンタミネーションが起こるものだと想定してがん遺伝子パネル検査の結果を解釈することが求められていきそうです。
その他にDNA検体を用いた臨床検査でクロスコンタミネーションが指摘された報告
その他にもいくつか、DNA検体のコンタミネーションが問題となった事例に関しての報告があります。下記にそれらを列記しておきます。




JCOの報告では、大規模な臨床試験で行われたハイボリューム検査センターでも検体取り扱いの問題から他者のDNAと結果が混ざってしまったという報告もあるようです。

クロスコンタミネーションを起こしたときの検査結果
がん遺伝子パネル検査(あるいはがん遺伝子プロファイリング検査)で検体のコンタミネーションが起こった場合にはどのような結果が返ってくると推測されるでしょうか。
端的には、本来ならVAFからSNPとして判定されてアノテーションの段階で除外される単塩基変異が軒並み低VAFのSNVとして報告されると思われます。しかしVAFが混入した他者DNA頻度と同等またはそのちょうど0.5倍で揃うので不自然な結果になりそうです。不自然なほど異様にSNVが多くTMBが高く算出される場合はクロスコンタミネーションの可能性を頭の片隅に置いておいた方が良いかもしれません。
検体提出前に腫瘍細胞含有率を測定しているのも腫瘍DNA内に混入した非腫瘍DNAのコンタミネーション率を前もって見積もっているのと同じことと言えます。DNA実際に腫瘍内に患者リンパ球が多数浸潤している場合は非腫瘍DNAの割合が高まり、その場合はたとえばTMBがcannot be determinedと判定されているレポートをご覧になったことがあるのでは無いかと思います。したがってTMBについてはコンタミネーションのリスクをある程度検査会社のほうでも差し引いてくれていると言えそうです。
またNCCオンコパネルでは血液検体を提出しているのでSNPかどうか判定できますので、やはり不自然であればアラートが来るはずです(骨髄移植後の場合はその確認の問い合わせが来ることがあるようです)。
他者のSNPがコンタミネーションによりSNVと判定されているかどうかの目安として、その塩基変異が比較的よく見られるSNPなのかを確認するという方法があります。日本人ではToMMo(東北メディカルメガバンク機構)のデータでどの程度の頻度で見られる塩基変化なのかを確認するという方法があります。1%以上の日本人に見られる塩基変化であればSNPの可能性があり治療標的とは考えにくくなります。
特殊例
NGSを用いたがん遺伝子プロファイリング検査で、コンタミネーションを起こしていなくてもクロスコンタミネーションを起こしたかのようなシークエンス結果が出るパターンはいくつかあります。
骨髄移植後症例
一つは過去に造血幹細胞移植などの治療を受けている場合。移植レシピエントに生じたがんの検体に移植ドナーの細胞が混入することが考えられ、これはコンタミネーションのように見えます。
出生時からキメラであったケース
比較的まれですが、本来双子として生まれるはずだった兄弟のDNAを取り込んでしまってキメラとして生まれた人の場合。いずれも被験者が普段から他者のDNAを体内に持った状態で生活していることに由来するので検査精度の問題ではありません。ちなみに、二卵性双生児の8%程度は双生児の片方の造血幹細胞を体内に取り込んだ血液キメラだそうです*2。
血液キメラなので組織DNAのみを使うT-only panelでは問題にならないように思いそうですが、雄マウスから雌マウスに骨髄移植したあとに雌マウスに生じた腫瘍からはY染色体が検出されることがあるという興味深い話があるように、血液キメラだからといって組織DNAにキメラDNAが検出されないとは言えず、知っておく必要がありそうです。
黄体細胞性粘膜腺癌
上記のキメラであったケースに生物学的に近いのかもしれませんが、Am J Clin Patholの文献で報告されているように黄体細胞性粘膜腺癌(paucicellular mucinous adenocarcinoma)の症例はキメラのようなDNAパターンを取ることがあります。
クロスコンタミネーションの防止のために
NGSを用いたがん遺伝子プロファイリング検査のクロスコンタミネーションの防止のために、病理検査室でも同時に複数検体を取り扱わないことなどに言及されています。

またthe College of American Pathologists guidelines*3やthe American College of Medical Genetics and Genomics clinical laboratory standards for NGS*4から検体取り扱いのための指針が提示されているようです。
また上述のTOP-GEAR計画の文献でもAm J Clin Patholの文献でも触れられているように、良質な検体を十分な量だけ採取するのが肝心なようです。FoundationOne CDxは50ngから検査自体はできるようですが、添付文書を見るとライブラリー調整後のQC規格値としてDNA収量545ng以上が必要とされているようです。キャプチャー法ではなくアンプリコンPCR法を使うオンコマインは10ngのDNAから検査が実施できるようですが、当然ながらコンタミネーションには注意が必要です。


この記事に対するコメント
このページには、まだコメントはありません。
*1 https://pubmed.ncbi.nlm.nih.gov/30742731/
*2 https://onlinelibrary.wiley.com/doi/abs/10.1002/(SICI)1096-8628(19960122)61:3%3C264::AID-AJMG11%3E3.0.CO;2-R
*3 CollegeofAmericanPathologists,Commissionon Laboratory Accreditation. Molecular Pathology Checklist. April 21, 2014 edition. Northfield, IL: College of American Pathologists; 2014.
*4 Genet Med. 2013;15:733-747.
更新日:2020-10-26 閲覧数:1753 views.